рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Закон равномерного распределения энергии по степеням свободы. Внутренняя энергия ИГ
Реферат Курсовая Конспект
Закон равномерного распределения энергии по степеням свободы. Внутренняя энергия ИГ
Закон равномерного распределения энергии по степеням свободы. Внутренняя энергия ИГ - раздел Образование, Основные положения молекулярно-кинетической теории. Масса и размер молекул Числом Степеней Свободы I Системы Называется Количество Независимых Ве...
Числом степеней свободы i системы называется количество независимых величин, с помощью которых может быть задано положение системы. Так, положение в пространстве материальной точки полностью определяется заданием значений трех ее координат x, y, z. В соответствии с этим материальная точка имеет три степени свободы.
Положение абсолютно твердого тела можно определить, задав три координаты его центра масс (x, y, z) и три угла поворота (например, вокруг осей, связанных с осями координат X, Y, Z). Таким образом, абсолютно твердое тело имеет шесть степенней свободы, из которых три являются поступательными и три – вращательными.
Для системы, состоящей из двух материальных точек, расстояние между которыми остается постоянным, число степенней свободы равно пяти, поскольку вращение вокруг одной из осей, а именно, оси, проходящей вдоль прямой, соединяющей эти точки, лишено смысла.
Для системы, состоящей из материальных точек, которые связаны не жесткой, а упругой связью, необходимо также учитывать колебательные степени свободы. Однако, в случае молекул газа, состоящих из нескольких атомов, учет колебательных степеней свободы производится только при высоких температурах (например, при Т > 1000 K).
Заметим, что, сколько бы степеней свободы ни имела молекула, всегда три из них – поступательные. Поскольку ни одна из поступательных степеней свободы молекулы не имеет преимущества перед остальными, на каждую из них приходится в среднем одинаковая энергия, равная одной трети значения (1.1), т. е. 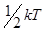 .
.
Этот результат является частным случаем закона равномерного распределения энергии по степеням свободы молекул идеального газа:
На каждую степень свободы молекулы приходится в среднем одинаковая кинетическая энергия равная 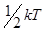 (k-постоянная Больцмана).
(k-постоянная Больцмана).
Тогда средняя кинетическая энергия молекулы равна:
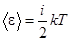 . (1.2)
. (1.2)
где i – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:
i = iпост+ iвращ+ 2 iколеб .
При определении 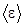 . учитывается, что колебательная степень свободы обладает вдвое большей энергетической емкостью по сравнению с поступательной или вращательной. Это объясняется тем, что колебательное движение связано с наличием как кинетической, так и потенциальной энергии, причем для гармонического осциллятора среднее значение кинетической и потенциальной энергии оказывается одинаковым.
. учитывается, что колебательная степень свободы обладает вдвое большей энергетической емкостью по сравнению с поступательной или вращательной. Это объясняется тем, что колебательное движение связано с наличием как кинетической, так и потенциальной энергии, причем для гармонического осциллятора среднее значение кинетической и потенциальной энергии оказывается одинаковым.
При низких температурах ( Т < 1000К ) i = iпост+ iвращ .
Внутренняя энергия тела равна сумме кинетической энергии хаотического движения молекул и потенциальной энергии взаимодействия между молекулами. В случае идеального газа взаимодействие между молекулами пренебрежимо мало, поскольку молекулы идеального газа подавляющую часть времени не взаимодействуют друг с другом. Взаимодействие имеет место при столкновениях молекул, т.е. при сближении молекул на очень малое расстояние. Однако такие столкновения в разреженном газе происходят редко.
Средняя кинетическая энергия поступательного движения молекулы идеального газа равна
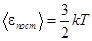 . Однако наряду с поступательным движением возможны также вращение молекулы и колебания атомов, входящих в состав молекулы. Оба эти вида движения связаны с некоторым запасом энергии, определить который позволяет установленный классической статистической физикой закон о равномерном распределении энергии по степеням свободы молекулы.
. Однако наряду с поступательным движением возможны также вращение молекулы и колебания атомов, входящих в состав молекулы. Оба эти вида движения связаны с некоторым запасом энергии, определить который позволяет установленный классической статистической физикой закон о равномерном распределении энергии по степеням свободы молекулы.
– Конец работы –
Эта тема принадлежит разделу:
Основные положения молекулярно-кинетической теории. Масса и размер молекул
М К т Изучает свойства вещества давление температуру и так далее как суммарный результат действий молекул при этом пользуется статическим...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Закон равномерного распределения энергии по степеням свободы. Внутренняя энергия ИГ
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов