рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- При их совместном присутствии
Реферат Курсовая Конспект
При их совместном присутствии
При их совместном присутствии - раздел Химия, Титриметрический (объемный) анализ Для Своего Варианта Рассчитать Навеску Вещества С Заданной Концентрацией В Тр...
Для своего варианта рассчитать навеску вещества с заданной концентрацией в требуемом объеме.
| № | Соединение | mн, г | См | Сн | % | Т×103 | r, г/см3 | V, л или m, кг |
| NaHCO3 Na2CO3 | 0,05 0,05 | 0,5 | ||||||
| NaHCO3 Na2CO3 | 0,03 0,06 | 0,5 | ||||||
| Na2CO3 NaHCO3 | 0,4 0,5 | 3,0 6,0 | 0,5 кг | |||||
| Na2CO3 NaHCO3 | 5,0 5,0 | 0,25 | ||||||
| NaHCO3 | 7,0 | 0,25 | ||||||
| Na2CO3 | 0,6 | 0,25 кг | ||||||
| NaHCO3 | 0,05 | 0,25 | ||||||
| NaHCO3 Na2CO3 | 0,06 0,05 | 0,25 | ||||||
| NaHCO3 Na2CO3 | 0,055 0,045 | 0,25 | ||||||
| NaHCO3 Na2CO3 | 0,2 0,8 | 0,25 кг | ||||||
| Na2CO3 NaHCO3 | 8,0 2,0 | 0,2 | ||||||
| Na2CO3 NaHCO3 | 4,0 6,0 | 0,25 | ||||||
| Na2CO3 NaHCO3 | 7,0 3,0 | 0,25 | ||||||
| Na HCO3 | 0,45 | 0,25 кг | ||||||
| NaНCO3 | 0,1 | 0,25 | ||||||
| Na2CO3 | 0,1 | 0,25 | ||||||
| NaHCO3 Na2CO3 | 0,01 0,09 | 0,2 | ||||||
| NaHCO3 | 0,38 | 0,25 кг | ||||||
| NaHCO3 Na2CO3 | 1,0 6,0 | 0,25 | ||||||
| Na2CO3 NaHCO3 | 3,0 7,0 | 0,25 | ||||||
| Na2CO3 NaHCO3 | 1,5 6,5 | 0,5 | ||||||
| Na2CO3 | 0,42 | 0,25 кг | ||||||
| NaHCO3 | 0,1 | 0,25 | ||||||
| Na2CO3 | 0,08 | 0,2 | ||||||
| NaHCO3 | 7,0 | 0,25 | ||||||
| Na2CO3 | 0,6 | 0,25 кг | ||||||
| NaHCO3 | 0,05 | 0,25 | ||||||
| NaHCO3 Na2CO3 | 0,06 0,05 | 0,25 | ||||||
| NaHCO3 | 0,38 | 0,25 кг |
Результаты занести в таблицу и показать преподавателю. После его разрешения приступить к приготовлению раствора.
| Соединение | mн, г | См | Сн | % | Т, г/мл | r, г/см3 | V, л или m, кг |
| NaHCO3 Na2CO3 |
Приготовление раствора солей нужной концентрации
Рассчитанную навеску солей (или одной соли) взвешивают на аналитических весах и количественно переносят в мерную колбу заданного объема (200 мл, 250 мл или 500 мл). Мерную колбу заполняют наполовину дистиллированной водой и растворяют навеску путем перемешивания. После растворения солей (или одной соли) доливают дистиллированную воду до метки мерной колбы и тщательно перемешивают.
Раствор переливают в пластмассовую бутылку и подписывают.
Содержание солей определяют путем титрования приготовленного раствора соляной кислотой, используя два индикатора: фенолфталеин и метиловый оранжевый. При титровании наблюдаются две точки эквивалентности: первая, когда «наполовину» нейтрализован Na2CO3, вторая, когда нейтрализован NaHCO3, содержащийся в исходной смеси и полученный в результате нейтрализации Na2CO3. В этот момент наступает полная нейтрализация смеси Na2CO3.
Na2CO3 + HCl ® NaHCO3 + NaCl (фенолфталеин)
NaHCO3 + HCl ® NaCl + CO2 + H2O (метиловый оранжевый)
Реактивы
Кислота хлористоводородная, НСl 0,1н раствор;
Индикаторы: фенолфталеин, метиловый оранжевый.
Ход определения
В бюретку до значения «0» заливают 0,1 н раствор HCl.
В коническую колбу емкостью 250 мл пипеткой переносят аликвотную часть приготовленного раствора, добавляют 2-3 капли фенолфталеина (раствор окрашивается в малиновый цвет) и по каплям приливают из бюретки 0,1 н раствор HCl до полного обесцвечивания раствора. Записывают объем раствора НС1, пошедший на титрование Vф. Затем в эту же колбу добавляют 2-3 капли метилового оранжевого (раствор окрашивается в желтый цвет) и продолжают тировать 0,1 н НС1 до перехода окраски в красновато-оранжевый цвет. Записывают объем раствора соляной кислоты, пошедший на титрование Vмо.
Проводят три параллельных опыта. В формулу для расчета подставляют среднее арифметическое значение трех параллельных определений: 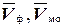 .
.
Расчетная часть
Содержание карбоната натрия и гидрокарбоната натрия определяют по формулам:
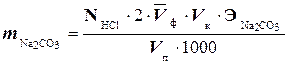 (г)
(г)
 (г)
(г)
где NHCl - нормальность раствора соляной кислоты;
 - эквивалентные массы карбоната натрия и гидрокарбоната натрия;
- эквивалентные массы карбоната натрия и гидрокарбоната натрия;
Vк и Vп - объемы соответственно мерной колбы и мерной пипетки, мл.
Принято экспериментальные данные и результаты расчетов выражать только значащими цифрами. Значащими называют все достоверно известные цифры плюс первая из недостоверных, т.е. все результаты следует округлять до первой недостоверной цифры.
Например, объем титранта, пошедший на титрование V = 12,5 мл.
Содержание определяемого вещества (г) записывают до трех значащих цифр. Например, 0,204; 0,0258 или 1,23. Нули, стоящие в начале числа всегда незначимы и служат лишь для указания места запятой в десятичной дроби.
– Конец работы –
Эта тема принадлежит разделу:
Титриметрический (объемный) анализ
На сайте allrefs.net читайте: "Титриметрический (объемный) анализ"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: При их совместном присутствии
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов