Теплоёмкость. Вычисление теплоты различных процессов - раздел Химия, ФИЗИЧЕСКАЯ ХИМИЯ Опытное Определение Удельной (С) Или Мольной (С) Теплоём...
Опытное определение удельной (с) или мольной (С) теплоёмкости тела заключается в измерении теплоты Q, поглощаемой при нагревании одного грамма или одного моля вещества на один градус при тех или иных условиях (постоянство давления или объёма или иные условия). При этом находят средние теплоёмкости в интервале температур T1¸T2:
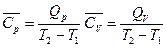 (I, 15)
(I, 15)
Истинные теплоёмкости связаны со средними теплоёмкостями соотношением:
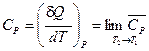 и
и 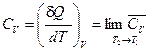 (I, 16)
(I, 16)
Истинные теплоёмкости вычисляются из средних.
Зависимость теплоёмкости от температуры не может быть определена через другие свойства вещества на основании законов термодинамики. Она изучается экспериментально, теория же этой проблемы разрабатывается методами квантовой статистической физики.
Ход теплоёмкостей в широком интервале температур охватывается обычно эмпирическим степенным рядом:
CP = a + bT + сT2 (I, 17)
Для значительного количества индивидуальных веществ значения коэффициентов a, b, с определены и приводятся в справочных таблицах.
Из уравнения (I, 16) следует:
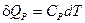 (I, 18)
(I, 18)
Проинтегрируем это выражение с учетом (I, 17):
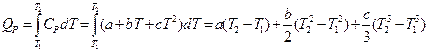 (I, 19)
(I, 19)
Полученная формула дает возможность вычислить теплоту любого процесса, связанного с изменением температуры в заданном интервале, если известна функциональная зависимость теплоёмкости от температуры.
Полученная формула также даёт возможность вычислить значение средней теплоёмкости в заданном интервале температур, если известна истинная теплоёмкость:
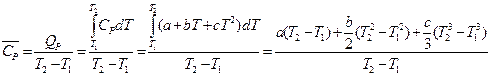 (I, 20)
(I, 20)
Попробуем решить обратную задачу нахождения истинной теплоёмкости по значению средней теплоёмкости. Из уравнений (I, 15) и (I, 16) следует:
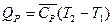 и
и 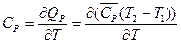 .
.
Если принять, что T1 = 0 и T2 обозначить как переменный параметр Т, то окончательно получим:
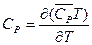 (I, 21)
(I, 21)
Таким образом, если известна функциональная зависимость средней теплоёмкости от температуры, то её подстановкой в (I, 21) и последующим дифференцированием по температуре легко найти истинную теплоёмкость.
Существует квантовая теория теплоёмкостей твёрдого тела П.Дебая, которая является приближённой общей теорией, основанной на использовании методов статистической механики.
По теории Дебая, теплоёмкость CV чистого твёрдого тела определяется формулой 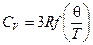 , где
, где 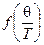 — некая функция отношения так называемой характеристической температуры q (температуры Дебая) и абсолютной температуры Т. Характеристическая температура может быть определена различными методами (по спектрам вещества, по его сжимаемости), а также вычислена по ряду полуэмпирических уравнений (уравнение Линдемана для одноатомных веществ и другие). Величина q имеет размерность температуры и зависит в основном от химического состава твёрдого тела и в очень малой степени от давления.
— некая функция отношения так называемой характеристической температуры q (температуры Дебая) и абсолютной температуры Т. Характеристическая температура может быть определена различными методами (по спектрам вещества, по его сжимаемости), а также вычислена по ряду полуэмпирических уравнений (уравнение Линдемана для одноатомных веществ и другие). Величина q имеет размерность температуры и зависит в основном от химического состава твёрдого тела и в очень малой степени от давления.
Анализ уравнения, предложенного Дебаем, показывает, что при высоких значениях Т молярная теплоёмкость твёрдых тел CV ® 3R = 25  . То, что теплоёмкости моноатомных твёрдых тел стремятся к одному и тому же значению, было замечено задолго до Дебая; это явление получило название закона Дюлонга-Пти.
. То, что теплоёмкости моноатомных твёрдых тел стремятся к одному и тому же значению, было замечено задолго до Дебая; это явление получило название закона Дюлонга-Пти.
В области низких температур:
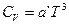 (I, 22)
(I, 22)
Это уравнение выражает известный закон Т-кубов Дебая, согласно которому при приближении к абсолютному нулю теплоёмкость пропорциональна температуре в третьей степени. Экспериментально было показано, что это верно для многих твёрдых тел.
Теория теплоёмкости для веществ, имеющих слоистую или цепочечную структуру, впервые была предложена В.В.Тарасовым. Он показал, что для слоистых структур (типа слюды) при низких температурах справедливо уравнение: 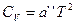 .
.
Аналогично, для одномерных кристаллов и цепочечных структур справедлива формула: 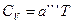 .
.
Таким образом, уравнения Тарасова дают возможность проводить расчет температурной зависимости теплоёмкости веществ, для которых уравнение Дебая принципиально неприменимо.
Все темы данного раздела:
Предмет физической химии и её значение
Взаимосвязь химических и физических явлений изучает физическая химия. Этот раздел химии является пограничным между химией и физикой. Пользуясь теоретическими и экспериментальными методами об
Краткий очерк истории развития физической химии
Термин «физическая химия» и определение этой науки впервые были даны М.В.Ломоносовым, который в 1752-1754 гг. читал студентам Академии наук курс физической химии и оставил рукопись этого курса «Вве
Энергия. Закон сохранения и превращения энергии
Неотъемлемым свойством (атрибутом) материи является движение; оно неуничтожимо, как и сама материя. Движение материи проявляется в разных формах, которые могут переходить одна в другую. Мерой движе
Предмет, метод и границы термодинамики
Сосредотачивая своё внимание на теплоте и работе, как формах перехода энергии при самых различных процессах, термодинамика вовлекает в круг своего рассмотрения многочисленные энергетические зависим
Теплота и работа
Изменения форм движения при его переходе от одного тела к другому и соответствующие превращения энергии весьма разнообразны. Формы же самого перехода движения и связанных с ним превращений энергии
Эквивалентность теплоты и работы
Постоянное эквивалентное отношение между теплотой и работой при их взаимных переходах установлено в классических опытах Д.П.Джоуля (1842-1867). Типичный эксперимент Джоуля заключается в следующем (
Внутренняя энергия
Для некругового процесса равенство (I, 1) не соблюдается, так как система не возвращается в исходное состояние. Вместо этого равенства для некругового процесса можно записать (опуская коэффициент
Первый закон термодинамики
Первый закон (первое начало) термодинамики непосредственно связан с законом сохранения энергии. Он позволяет рассчитывать баланс энергии при протекании различных процессов, в том числе и химических
Уравнения состояния
Многие свойства системы, находящейся в равновесии, и составляющих её фаз являются взаимозависимыми. Изменение одного из них вызывает изменение других. Количественные функциональные зависимости межд
Работа различных процессов
Под названием работы объединяются многие энергетические процессы; общим свойством этих процессов является затрата энергии системы на преодоление силы, действующей извне. К таким процессам относится
Калорические коэффициенты
Внутренняя энергия системы U, будучи функцией состояния, является функцией независимых переменных (параметров состояния) системы.
В простейших системах будем рассматривать внутренню
Применение первого закона термодинамики к идеальному газу.
Рассмотрим идеальный газ, т. е. газ, состояние одного моля которого описывается уравнением Менделеева‑Клапейрона:
Адиабатические процессы в газах
Говорят, что термодинамическая система совершает адиабатический процесс, если он обратим и если система термически изолирована, так что во время процесса не происходит теплообмена между системой и
Энтальпия
Уравнение первого закона термодинамики для процессов, где совершается только работа расширения, приобретает вид:
δQ = dU + PdV (I, 51)
Если процесс идет при постоянном
Химическая переменная. Формулировка первого закона термодинамики для процессов, сопровождающихся химическими и фазовыми превращениями
Уравнения (I, 27), (I, 28) и ранее приведённые формулировки первого закона термодинамики справедливы для любой равновесной закрытой системы вне зависимости от того, происходят в ней химические или
Термохимия. Закон Гесса
При химических превращениях происходит изменение внутренней энергии системы, обусловленное тем, что внутренняя энергия продуктов реакции отличается от внутренней энергии исходных веществ.
Зависимость теплового эффекта от температуры. Уравнение Кирхгофа.
По закону Гесса можно вычислить тепловой эффект реакции при той температуре, при которой известны теплоты образования или теплоты сгорания всех реагентов (обычно это 298К). Однако, часто воз
Самопроизвольные и несамопроизвольные процессы
Из первого закона термодинамики и вытекающих из него закономерностей обмена энергией между телами при различных процессах нельзя сделать вывода о том, возможен ли, вообще говоря, данный процесс и в
Второй закон термодинамики
Наиболее часто встречающимися и безусловно самопроизвольными являются процессы передачи теплоты от горячего тела к холодному (теплопроводность) и перехода работы в теплоту (трение). Многовековая жи
Методы расчета изменения энтропии
Уравнения (II, 12) и (II, 13), определяющие энтропию, являются единственными исходными уравнениями для термодинамического расчета изменения энтропии системы. Заменяя элементарную теплоту в уравнени
Постулат Планка
По уравнению (II, 3) невозможно вычислить абсолютное значение энтропии системы. Такую возможность дает новое, недоказуемое положение, не вытекающее из двух законов термодинамики, которое было сформ
Абсолютные значения энтропии
Постулат Планка используется при термодинамическом исследовании химических процессов для вычисления абсолютных значений энтропии химических соединений — величин, которые имеют большое значение при
Стандартная энтропия. Изменение энтропии при протекании химической реакции
Энтропию, как и другие термодинамические функции, принято относить к стандартному состоянию вещества.
Напомним, что стандартное состояние характеризуется стандартными усло
Статистическая интерпретация энтропии
В основу понятия энтропии как функции состояния положена макроскопическая концепция. Справедливость второго закона термодинамики связана с реальностью необратимых процессов. В отличие от необратимы
Энергия Гельмгольца
Напомним, что второй закон термодинамики определяет критерии самопроизвольного протекания процессов в изолированных системах. Однако, подобные условия (отсутствие обмена энергией и веществом с окр
Энергия Гиббса
Желая учесть в общей форме другие виды работы, кроме работы расширения, представим элементарную работу как сумму работы расширения и других видов работы:
dW = PdV + dW' (III, 15)
Характеристические функции. Фундаментальные (канонические) уравнения состояния
Ранее мы определили следующие термодинамические функции — свойства системы: внутреннюю энергию U, энтальпию H, энтропию S, энергию Гельмгольца F, энергию Гиббса G
Соотношения Максвелла.
Рассмотрим теперь вторые смешанные производные характеристических функций. Принимая во внимание уравнения (III, 26), можем записать:
Уравнение Гиббса‑Гельмгольца
Уравнение Гиббса-Гельмгольца позволяет определять изменение энергии Гиббса, сопровождающее химические реакции при любой заданной температуре, если известна зависимость теплоты химических реакций от
Энергия Гиббса смеси идеальных газов. Определение химического потенциала.
Энергия Гиббса является экстенсивной функцией, что позволяет рассчитать ее значение для смеси идеальных газов.
Представим себе резервуар, разделенный перегородками на секции, как показано
Химический потенциал
Чтобы прояснить смысл понятия «химический потенциал», продифференцируем выражение (III,51) как произведение при постоянных Р и Т:
Фазовые переходы. Уравнение Клапейрона-Клаузиуса.
В системе, состоящей из нескольких фаз чистого вещества, находящихся в равновесии, возможны переходы вещества из одной фазы в другую. Такие переходы называются фазовыми переходами.
Фазовые переходы первого рода. Плавление. Испарение
Фазовые переходы, характеризующиеся равенством изобарных потенциалов двух сосуществующих в равновесии фаз и скачкообразным изменением первых производных по энергии Гиббса (энтропии и объема) при пе
Фазовые переходы второго рода
Фазовый переход второго рода — это равновесный переход вещества из одной фазы в другую, при котором скачкообразно изменяются только вторые производные от энергии Гиббса по температуре и давлению.
Зависимость давления насыщенного пара от температуры
Давление насыщенного пара жидкости резко увеличивается с повышением температуры. Это видно из рисунка 12, на котором изображены кривые давления пара некоторых жидкостей, начинающиеся в точках плавл
Общие условия равновесия
Любая закрытая система, находящаяся в равновесии при постоянных давлении и температуре, характеризуется соотношением:
Правило фаз Гиббса
В 1876 г. Гиббс вывел простую формулу, связывающую число фаз (Ф), находящихся в равновесии, число компонентов (К) и число степеней свободы (С) системы. При равновесии должны бы
Применение правила фаз Гиббса к однокомпонентным системам. Диаграммы состояния воды и серы
Для однокомпонентной системы К =1 и правило фаз записывается в виде:
С = 3 – Ф
Если Ф = 1, то С =2 , говорят, что система бивариантна;
Фазовая диаграмма воды.
Состояние воды изучено в широком диапазоне температур и давлений. При высоких давлениях установлено существование не менее десяти кристаллических модификаций льда. Наиболее изученным является лед I
Фазовая диаграмма серы.
Кристаллическая сера существует в виде двух модификаций — ромбической (Sр) и моноклинной (Sм). Поэтому возможно существование четырех фаз: ромбической, мо
Закон действующих масс. Константа равновесия для газофазных реакций
Допустим, что между газообразными веществами А1, А2 … Аi, А’1, А’2 … А’i протекает химически обратимая реакция по уравнению:
Уравнение изотермы химической реакции
Предположим, в смеси идеальных газов протекает химическая реакция по уравнению
Допустим, что в момент приг
Представление о химическом сродстве
Из того факта, что одни вещества реагируют друг с другом легко и быстро, другие с трудом, третьи — совсем не реагируют, возникает предположение о наличии или отсутствии особого химического сродства
Использование закона действующих масс для расчета состава равновесных смесей
Для определения состава системы при установившемся равновесии, а следовательно, и выхода продукта (продуктов) реакции необходимо знать константу равновесия и состав исходной смеси.
Состав
Гетерогенные химические равновесия
Закон действующих масс был выведен с использованием закона состояния идеальных газов и применим в первую очередь к газовым смесям. Однако его без существенных изменений можно применить и к значител
Влияние температуры на химическое равновесие. Уравнение изобары химической реакции
Для определения зависимости K0от температуры в дифференциальной форме воспользуемся уравнением Гиббса‑Гельмгольца (III, 41)
Принцип Ле Шателье‑Брауна
Выведенная из состояния равновесия система вновь возвращается к состоянию равновесия. Ле Шателье и Браун высказали простой принцип, которым можно воспользоваться для предсказания того, в каком напр
Тепловая теорема Нернста
Прямой и простой расчет изменения энергии Гиббса, а, следовательно, и констант равновесия химических реакций не вызывает затруднений, если известны теплота химической реакции и абсолютные значения
Химическое равновесие в неидеальных системах
Закон действующих масс (V, 5) применим, как уже говорилось, лишь к идеальным газам (или идеальным растворам). Для таких систем произведение равновесных относительных парциальных давлений реагирующи
Зависимость энтальпии веществ и тепловых эффектов химических реакций от давления
При рассмотрении зависимости энтальпии от давления воспользуемся хорошо нам известным выражением ее полного дифференциала (III, 27):
dH = VdP + TdS
Разделим е
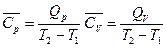 (I, 15)
(I, 15)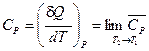 и
и 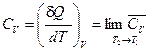 (I, 16)
(I, 16)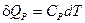 (I, 18)
(I, 18)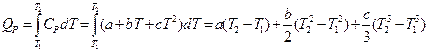 (I, 19)
(I, 19)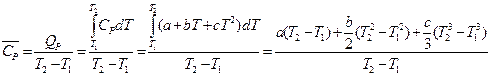 (I, 20)
(I, 20)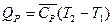 и
и 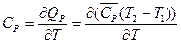 .
.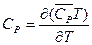 (I, 21)
(I, 21)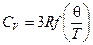 , где
, где 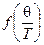 — некая функция отношения так называемой характеристической температуры q (температуры Дебая) и абсолютной температуры Т. Характеристическая температура может быть определена различными методами (по спектрам вещества, по его сжимаемости), а также вычислена по ряду полуэмпирических уравнений (уравнение Линдемана для одноатомных веществ и другие). Величина q имеет размерность температуры и зависит в основном от химического состава твёрдого тела и в очень малой степени от давления.
— некая функция отношения так называемой характеристической температуры q (температуры Дебая) и абсолютной температуры Т. Характеристическая температура может быть определена различными методами (по спектрам вещества, по его сжимаемости), а также вычислена по ряду полуэмпирических уравнений (уравнение Линдемана для одноатомных веществ и другие). Величина q имеет размерность температуры и зависит в основном от химического состава твёрдого тела и в очень малой степени от давления. . То, что теплоёмкости моноатомных твёрдых тел стремятся к одному и тому же значению, было замечено задолго до Дебая; это явление получило название закона Дюлонга-Пти.
. То, что теплоёмкости моноатомных твёрдых тел стремятся к одному и тому же значению, было замечено задолго до Дебая; это явление получило название закона Дюлонга-Пти.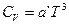 (I, 22)
(I, 22)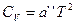 .
.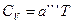 .
. 






Новости и инфо для студентов