рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Химические свойства
Реферат Курсовая Конспект
Химические свойства
Химические свойства - раздел Химия, ОБЩИЕ ЗАКОНОМЕРНОСТИ СТРОЕНИЯ И ХИМИЧЕСКОГО ПОВЕДЕНИЯ ОКСОСОЕДИНЕНИЙ 1. Использование Ангидридов Как Ацилирующих Средств. Анг...
1. Использование ангидридов как ацилирующих средств. Ангидриды, как и галогенангидриды, обладают большой химической активностью, являются хорошими ацилирующими средствами (часть 1, глава 8.5.2, часть 2, глава 2, 3.3, часть 3, глава 1), вступая в те же реакции, что и галогенангидриды, однако менее энергично:
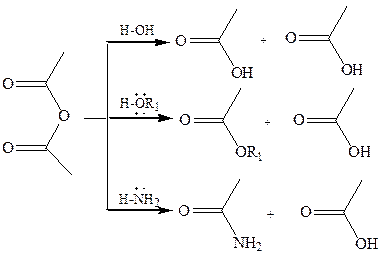
4.2.2.3 АМИДЫ КАРБОНОВЫХ КИСЛОТ– функциональные производные кислот, в которых гидроксил карбоксильной группы замещен на аминогруппу. У амидов в аминогруппе атомы водорода могут быть замещены на углеводородные радикалы. В таком случае их называют N-алкил- или N-ариламидами. Амиды также можно рассматривать как производные аммиака, у которого атом водорода замещен на ацильный остаток.
Амиды представляют собой бесцветные кристаллические вещества или жидкости, растворяющиеся в воде и органических растворителях. Амиды, в молекулах которых имеются связи N–Н, ассоциированы вследствие образования межмолекулярных водородных связей и имеют более высокие температуры кипения.
В амидной группе связи делокализованы благодаря плоскому строению и наличию n,π-сопряженной системы. Это приводит к перераспределению электронной плотности: на атоме азота электронная плотность по сравнению с аммиаком и аминами понижается, а на углеродном атоме по сравнению с альдегидами и кетонами повышается. Амиды с низкой молекулярной массой высокополярны и хорошо растворимы в воде. Их часто используют в качестве растворителей.
В молекулах амидов осуществляется значительное взаимодействие между НЭП атома азота и π-электронной системой двойной связи С=О. Образуется сопряженная система связей, изменяются природа связей С–N и С–О и распределение электронной плотности. В результате связь С–N становится короче, а связь С=О несколько длиннее по сравнению с несопряженными соединениями:
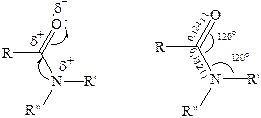
Сравнение основных свойств аминов и амидов. Основность амидов меньше, чем у аммиака и алифатических аминов. В молекуле амида есть два основных центра электрофильной атаки – атомы азота и кислорода, к которым может присоединяться протон. На атоме азота электронная плотность понижена и более выгодной является атака протона по кислороду, при которой сохраняется стабильная сопряженная система связей.
Амиды, содержащие N–H связи, обладают слабокислыми свойствами, но являются более сильными кислотами, чем аммиак. В водном растворе амиды дают нейтральную реакцию. Однако, при взаимодействии с активными металлами амиды, содержащие N–H связи, отщепляют протон, так как при этом образуется стабилизированный делокализацией отрицательного заряда амид-анион.
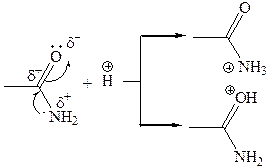
| потеря сопряженной системы сопряженная система сохраняется |
У циклических амидов (имидов) кислотность выражена более ярко, так как атом азота находится под влиянием двух карбонильных групп.
По сравнению с аминами амиды карбоновых кислот являются слабыми основаниями ввиду сильного взаимодействия неподеленной электронной пары атома азота с карбонильной группой.
– Конец работы –
Эта тема принадлежит разделу:
ОБЩИЕ ЗАКОНОМЕРНОСТИ СТРОЕНИЯ И ХИМИЧЕСКОГО ПОВЕДЕНИЯ ОКСОСОЕДИНЕНИЙ
Карбонильные соединения подразделяют в зависимости от... числа карбонильных групп в молекуле и присутствия других функциональных... монокарбонильные соединения...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Химические свойства
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов