рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Реакции окисления-восстановления (диспропорционирования)
Реферат Курсовая Конспект
Реакции окисления-восстановления (диспропорционирования)
Реакции окисления-восстановления (диспропорционирования) - раздел Химия, ОБЩИЕ ЗАКОНОМЕРНОСТИ СТРОЕНИЯ И ХИМИЧЕСКОГО ПОВЕДЕНИЯ ОКСОСОЕДИНЕНИЙ 6.1 Реакция Канниццаро (1853 Г.) Характерна Для А...
6.1 Реакция Канниццаро (1853 г.) характерна для альдегидов, не содержащих в α-положении водородных атомов, и происходит при их обработке концентрированными растворами щелочей. Если в α-положении имеются водородные атомы, то при обработке карбонильного соединения раствором щелочи протекает более быстрая реакция альдольной конденсации (п. 8.2), сопровождающаяся процессами олигомеризации и осмоления.
Реакция Канниццаро – окислительно-восстановительный процесс (диспропорционирование), протекающий под действием концентрированного водного или водно-спиртового раствора щелочи при слабом нагревании в присутствии катализаторов (Со, Ni, Аg, Сu или их оксидов:
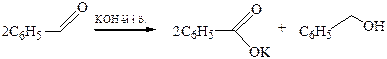
Поскольку реакция происходит в щелочной среде, то конечными продуктами превращения являются соль кислоты и спирт.
Механизм реакции Канниццаро:
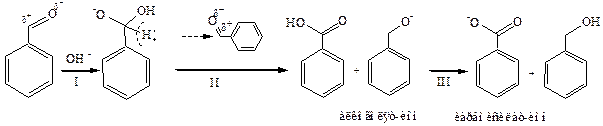
Ключевой стадией этого процесса является II стадия – передача гидрид-иона. Роль щелочи заключается в переводе альдегида в анион гидратной формы путем присоединения ОН-аниона как нуклеофила к карбонильной группе (I стадия). Образовавшийся анион имеет возможность передать гидрид-ион другой молекуле, поскольку при этом возникает стабильная молекула кислоты (II стадия). Реакция завершается быстрым обменом протона (III стадия). Движущей силой этой реакции является образование сопряженного карбоксилат-иона.
В реакцию Канниццаро могут вступать и два различных альдегида. В этом случае ее называют перекрестной. Если в реакции принимают участие два альдегида с приблизительно одинаковой реакционной способностью, то в результате получается смесь четырех продуктов – два спирта и соли двух кислот. Если же активность различна, то альдегид, более активный в АN реакциях, активируется щелочью и затем передает гидрид-ион второму альдегиду. Поэтому в результате реакции образуются два продукта – соль кислоты из более активного альдегида и спирт, например:
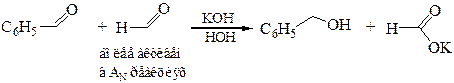
6.2 Реакция Тищенко (1906 г.). В эту реакцию вступают только альдегиды, образуя под действием каталитических количеств этилата алюминия сложный эфир – продукт взаимодействия кислоты и спирта:
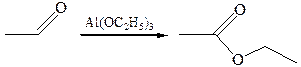
Реакция также протекает с переносом гидрид-иона от одной молекулы альдегида к другой под действием алкоголята алюминия:
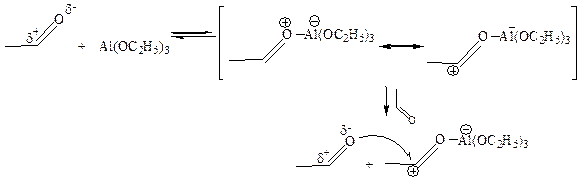
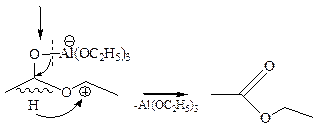
Несмотря на наличие водорода в α-положении, альдольная конденсация здесь не протекает, так как алкоголяты алюминия слабые основания, не способные отщеплять протон в α-положении к карбонилу.
Реакцию Тищенко проводят в отсутствие воды и спирта. Наличие воды в реакционной смеси приведет к гидролизу алкоголята и сложного эфира, а в присутствии спирта может произойти реакция Меервейна-Понндорфа.
6.3 Реакция Меервейна–Понндорфа (1925 г.). Классическим примером данной реакции является взаимодействие кетонов с изопропилатом алюминия в изопропиловом спирте:
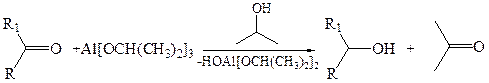
Источником гидрид-иона в этом процессе является изопропилат алюминия. На первой стадии имеет место ассоциация кетона с алкоголятом алюминия как кислотой Льюиса. Связь С=О еще более поляризуется, и затем происходит перенос гидрид-иона в циклическом (шестичленном) переходном состоянии:
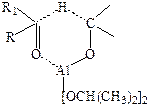
Образовавшийся смешанный алкоголят затем разрушается с образованием спирта – конечного продукта восстановления кетона.
7. Полимеризация альдегидов. Благодаря π-связи карбонильные соединения должны проявлять склонность к реакциям полимеризации с образованием гетероцепных полимеров, в полимерной цепи которых кроме атомов углерода находятся другие атомы – атомы кислорода. Молекулы альдегидов, таких, как формальдегид и ацетальдегид, способны к полимеризации с образованием циклических и линейных полимеров.
7.1Полимеризация формальдегида до циклического ацеталя – триоксиметилена (триоксана) – при температуре ниже 80 °С:
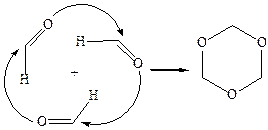
Циклоолигомеризация формальдегида протекает специфично. Например, в присутствии серной кислоты образуется не тример, а тетрамер (тетраоксиметилен), в основе молекулы которого лежит восьмичленный цикл.
7.2 Полимеризация ацетальдегида в присутствии сильных кислот при 20 °С с образованием паральдегида (тример), а при 0 °С – метальдегида (тетрамер):
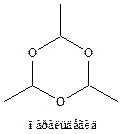
| 
|
Оба соединения деполимеризуются при нагревании с серной кислотой. Паральдегид используется как снотворное, а метальдегид – в качестве средства для борьбы с улитками, а также как сухое топливо.
8. Реакции с участием α-водородных атомов. Енолизация, кетоенолъная таутомерия. Карбонильная группа альдегидов и кетонов оказывает сильное электроноакцепторное влияние на соседние с ней атомы углерода. Это обуславливает высокую подвижность атома водорода при α-углеродном атоме и возможность его миграции к атому кислорода карбонильной группы. Образующиеся при этом непредельные спирты называются енолами, а сам процесс – енолизацией. Енолизация карбонильных соединений обратима:
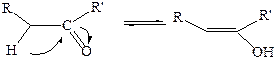
Такие взаимопревращения могут катализироваться как кислотами, так и основаниями. В случае простых альдегидов и кетонов равновесие сильно сдвинуто в сторону образования кето-формы, что связано с величиной энергии соответствующих связей в кето- (С–Н; С–С и С=О) и енольной формах (С=С; С–О и О–Н). Суммарная энергия трех первых связей составляет приблизительно 360 ккал/моль, а других трех связей – 345 ккал/моль. Таким образом, кето-форма более устойчива, чем енольная.
8.1 Галогенирование карбонильных соединений. Альдегиды и кетоны, имеющие подвижный атом водорода при α-углеродном атоме, легко вступают в реакции галогенирования в присутствии как кислот, так и оснований:
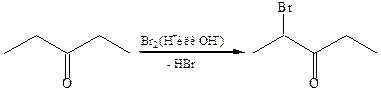
При кислотном катализе происходит протонирование карбонильной группы. В образующемся полярном аддукте происходит депротонирование С–Н связи при α-углеродном атоме и образование енола:
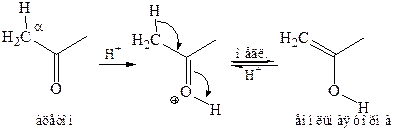
В дальнейшем осуществляется взаимодействие енольной формы кетона с галогеном, имеющее общие черты с электрофильным присоединением галогена к алкенам:
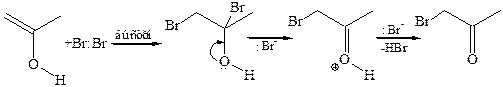
В присутствии сильного основания кето-форма карбонильного соединения депротонируется по α-углеродному атому с образованием резонансно-сопряженного енолят-иона, который вследствие высокой нуклеофильности быстро взаимодействует с молекулой галогена:
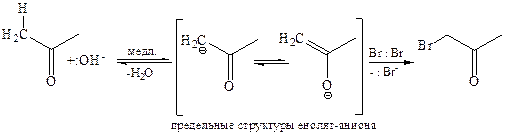

Скорость реакции галогенирования альдегидов и кетонов зависит не от вида галогена, а только от вида и количества катализатора, определяющего лимитирующую стадию процесса – образование енола или енолят-аниона, которые затем быстро атакуются реагентом.
8.2 Альдольная и кротоновая конденсация заключается в самоконденсации альдегидов и кетонов и протекает в очень мягких условиях. Катализаторами процесса могут быть как основания, так и кислоты Однако чаще всего проводят конденсацию в щелочной среде (NаОН, Na2СО3, К2СО3, Ва(ОН)2). Под влиянием разбавленного основания две молекулы оксосоединения могут вступать в реакцию конденсации с образованием β-гидроксиальдегида (альдоля) или β-гидроксикетона.
8.2.1 Образование простейшего альдоля из уксусного альдегида впервые наблюдал в 1872 г. русский химик и композитор А. П. Бородин:
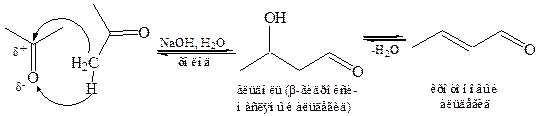
При нагревании альдоль легко отщепляет воду, что приводит к образованию α, β-непредельного соединения. В случае реакции Бородина образуется кротоновый альдегид, имеющий сопряженную систему связей. Поэтому часто этот процесс называют кротонизацией, а реакцию в целом – альдольно-кротоновой конденсацией.
По механизму альдольная конденсация может быть отнесена к АN реакциям, причем одна молекула альдегида выступает в роли карбонильной, а другая – в роли метиленовой компоненты. Механизм альдольной конденсации складывается из следующих стадий:
I стадия – активация реагента, образование активного карбаниона:
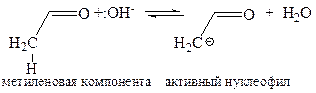
II стадия – АN реакция по карбонильному углероду с образованием связи С–С:
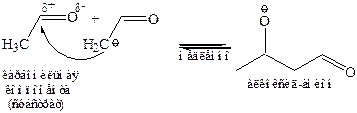
III стадия – протонирование алкоксид-иона и регенерация катализатора:
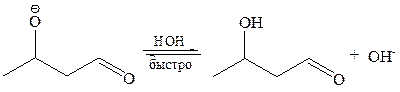
Последняя стадия протекает легко, так как алкоксид-ион – более сильное основание, чем гидроксид-ион.
Альдольная конденсация – обратимая реакция, обратный процесс превращения альдоля в исходное карбонильное соединение носит название ретроальдольного распада который примечателен тем, что в результате происходит катализируемый основанием разрыв связи С–С.
8.2.2 Альдольная конденсация кетонов. Кетоны труднее вступают в реакцию конденсации из-за совместного действия электронного и пространственного факторов. Реакция катализируется менее растворимыми в воде основаниями Ва(ОН)2, Аl(ОН)3, для проведения реакции требуется более высокая температура:
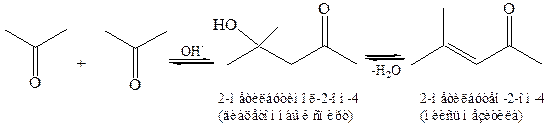
8.2.3 Смешанная альдольная конденсация между различными оксосоединениями, особенно в тех случаях, когда одна молекула карбонильного соединения не имеет α-Н-атома и может выступать поэтому только в качестве карбонильной компоненты, например:

При кислотном катализе механизм альдольной конденсации иной. Под действием протона одна молекула (карбонильная компонента) оксосоединения превращается в карбокатион, а другая (метиленовая компонента) – в енол, после чего следует стадия присоединения:
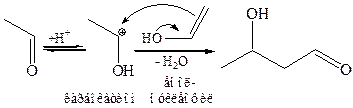
Альдоль в кислой среде быстро превращается в α, β-непредельное соединение, поскольку протон катализирует и реакцию дегидратации спиртов.
8.2.4 Кротоновая конденсация – взаимодействие двух молекул карбонильного соединения друг с другом в присутствии оснований или кислот, сопровождающееся отщеплением воды и образованием непредельного карбонильного соединения.
Основной катализ обычно осуществляется при нагревании. Катализатор сначала обеспечивает образование альдоля, а затем его протонирование по α-углеродному по отношению к карбонильной группе атому (гиперконъюгация). На завершающей стадии процесса происходит отщепление гидроксид-аниона:
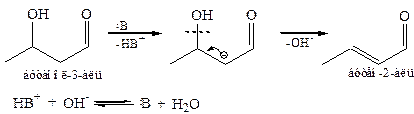
Кротоновая конденсация широко используется для синтеза непредельных альдегидов и кетонов, в частности для промышленного синтеза кротонового альдегида.
8.3 Реакция Перкина (1868 г.). В эту реакцию вступают ароматические альдегиды (карбонильная компонента) и ангидриды карбоновых кислот (метиленовая компонента) Процесс протекает по типу альдольной конденсации. Промежуточные аддукты легко дегидратируются с образованием α, β-непредельных соединений. В качестве катализатора используют ацетат или карбонат натрия (калия), анион которых выступает в роли мягкого основания, активирующего метиленовую компоненту. Реакцию проводят при длительном и сильном нагревании, что исключает возможность использования алифатических альдегидов:
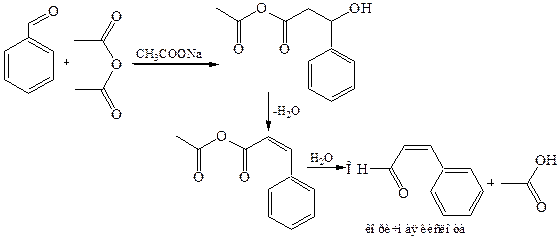
8.4 Коденсация Кляйзена-Шмидта (1881 г.). Реакция является одним из важнейших вариантов смешанной конденсации. В качестве карбонильной компоненты в этом случае используются ароматические альдегиды, а в роли метиленовой компоненты – алифатические альдегиды и кетоны.
8.4.1 Синтез коричного альдегида:
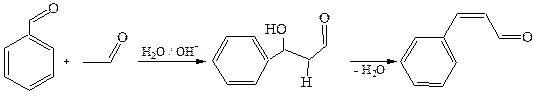
8.4.2 Синтез бензаль- и дибензальацетона:

Механизм этих реакций аналогичен механизму альдольной конденсации. Однако альдоль в чистом виде выделить невозможно, так как он легко дегидратируется, поскольку при дегидратации образуются соединения, содержащие протяженную сопряженную систему связей.
Реакции конденсации широко используются для решения многих синтетических задач, в частности:
· для удлинения углеродной цепи, являющегося результатом присоединения метиленовой компоненты к карбонильному углероду;
· для получения α, β-ненасыщенных альдегидов, кетонов, карбоновых кислот;
· для синтеза насыщенных и ненасыщенных высших спиртов, которые получаются последующим восстановлением α, β-непредельных альдегидов и кетонов.
Важнейшие представители. Муравьиный альдегид(формальдегид, метаналь) – бесцветный газ с резким специфическим запахом, прекрасно растворим в воде, 40 % водный раствор формальдегида называют формалином. Формалин – дезинфицирующее и дезодорирующее средство, его используют для обеззараживания зерно- и овощехранилищ, теплиц, парников, для хранения анатомических препаратов, бальзамирования и дубления кож и т. д. Формальдегид широко используют в органическом синтезе, в производстве синтетических смол (фенолформальдегидных, карбамидных и др.) и пластмасс, многих лекарственных препаратов и красителей. Формальдегид токсичен, действует раздражающе на слизистые оболочки глаз и дыхательных путей, вызывает дегенеративные изменения в паранхиматизных органах.
Водные растворы формальдегида содержат равновесную смесь моногидрата СН2(ОН)2 (99,9 %), неустойчивого в свободном состоянии, и линейных полимергидратов НО–(–СН2–О–)n –Н (n = 2–8) устойчивых кристаллических соединений. При продолжительном хранении таких водных растворов (особенно при низких температурах) или при их концентрировании степень полимеризации увеличивается, например до n = 8–100 у параформа (параформальдегида). В процессе нагревания с разбавленной серной кислотой параформ разлагается до газообразного формальдегида. На этом и основано его применение в качестве транспортабельного сырья для получения формальдегида. Спрессованные палочки параформа используют и как горючее.
Анионной или катионной полимеризацией формальдегида получают полиформальдегид (n > 1 000), который при сильном нагревании также деполимеризуется. При введении в концевые гидроксильные группы защитных группировок (метокси- или сульфогрупп) стабильность полимера заметно возрастает. В таком виде полиформальдегид широко применяется в качестве конструкционного материала для замены цветных металлов и сплавов в машино-, автомобиле- и приборостроении, а также для формирования полиформальдегидных волокон технического назначения.
Уксусный альдегид(ацетальдегид, этаналь) – бесцветная жидкость с резким удушающим запахом, при разбавлении водой ацетальдегид приобретает запах зеленых яблок. Соединение смешивается во всех соотношениях с водой и с большинством органических растворителей. Ацетальдегид применяют в производстве ацетатов целлюлозы, уксусной и пероксиуксусной кислот, уксусного ангидрида, этилацетата, глиоксаля, алкиламинов, бутанола, пентаэритрита, алкилпиридинов, хлораля, как восстановитель при изготовлении зеркал. Подобно формальдегиду, он вступает в реакции поликонденсации с аминами, фенолом и другими веществами, образуя синтетические смолы, широко применяемые в промышленности.
Пары этого вещества вызывают раздражение слизистых оболочек, головную боль, в тяжелых случаях – пневмонию и отек легких.
Ацетон(2-пропанон, диметилкетон) – летучая бесцветная жидкость с характерным запахом, хорошо смешивается с водой и многими органическими растворителями (простыми и сложными эфирами, метанолом, этанолом и др.). Ацетон – растворитель, широко применяемый в лакокрасочной промышленности, в производстве ацетатного шелка, кинопленки, пироксилина (бездымного пороха). Благодаря сравнительно малой токсичности он используется в пищевой и фармацевтической промышленности. Ацетон служит сырьем для синтеза кетена, уксусного ангидрида, метилметакрилата, который широко используется при синтезе органического стекла и многих других соединений. Как один из продуктов метаболизма высших жирных кислот в живых организмах ацетон и некоторые кетокислоты (кетоновые, или ацетоновые, тела) могут накапливаться в организме человека, являясь одним из признаков такого тяжелого заболевания, как сахарный диабет.
Акролеин(пропеналь, акриловый альдегид) – бесцветная жидкость с удушливым запахом, растворяется во многих органических растворителях, плохо растворим в воде. Акролеин используют для получения пластмасс, отличающихся большой твердостью. При его конденсации с пентаэритритом получают полимеры по внешнему виду похожие на стекло. Это соединение также применяют для синтеза глицерина, акрилонитрила, аминокислоты метионина, глутарового альдегида, полиакролеина. Полиакролеин и его натриевые соли являются эмульгаторами, структурирующими почвы, лактонные его производные улучшают свойства бумаги и текстильных изделий. Сильно раздражает слизистые оболочки глаз и дыхательных путей, обладает токсическим действием.
Кротоновый альдегид(2-бутеналь) – бесцветная жидкость с резким запахом, растворяется в воде (18,1 г на 100 г воды при 20 °С) и в некоторых органических растворителях. Кротоновый альдегид используют для получения бутанола, сорбиновой и масляной кислот, а также малеинового ангидрида. Продукт сополимеризации кротонового альдегида и 1-винил-2-пирролидона является антикоагулянтом крови. Кротоновый альдегид сильный лакриматор, при попадании на кожу вызывает местную воспалительную реакцию с последующим изъязвлением верхнего слоя кожи.
– Конец работы –
Эта тема принадлежит разделу:
ОБЩИЕ ЗАКОНОМЕРНОСТИ СТРОЕНИЯ И ХИМИЧЕСКОГО ПОВЕДЕНИЯ ОКСОСОЕДИНЕНИЙ
Карбонильные соединения подразделяют в зависимости от... числа карбонильных групп в молекуле и присутствия других функциональных... монокарбонильные соединения...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Реакции окисления-восстановления (диспропорционирования)
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов