рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Общие способы получения дикарбоновых кислот
Реферат Курсовая Конспект
Общие способы получения дикарбоновых кислот
Общие способы получения дикарбоновых кислот - раздел Химия, ОБЩИЕ ЗАКОНОМЕРНОСТИ СТРОЕНИЯ И ХИМИЧЕСКОГО ПОВЕДЕНИЯ ОКСОСОЕДИНЕНИЙ 1. Окисление Диолов И Циклических Кетонов: ...
1. Окисление диолов и циклических кетонов:
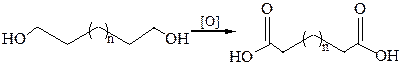
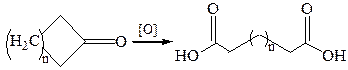
2. Гидролиз нитрилов:
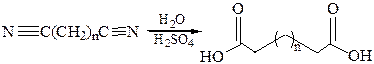
3. Карбонилирование диолов:
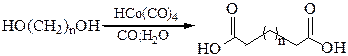
4. Получение щавелевой кислоты из формиата натрия сплавлением его в присутствии твердой щелочи:
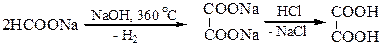
5. Получение малоновой кислоты:
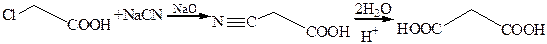
6. Получение адипиновой кислоты. В промышленности получается при окислении циклогексанола 50 % азотной кислотой в присутствии медно-ванадиевого катализатора:
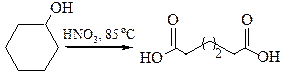
Физические свойства дикарбоновых кислот. Дикарбоновые кислоты – твердые вещества. Низшие члены ряда хорошо растворимы в воде и лишь незначительно растворяются в органических растворителях. Растворяясь в воде, образуют межмолекулярные водородные связи. Граница растворимости в воде лежит при С6 – С7. Эти свойства кажутся вполне естественными, поскольку полярная карбоксильная группа составляет значительную часть в каждой из молекул.
Таблица 26 – Физические свойства дикарбоновых кислот
| Название | Формула | Т.пл. °С | Растворимость при 20 °С, г/100 г | 105×K1 | 105×K2 |
| Щавелевая | 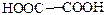
| 5,2 | |||
| Малоновая | 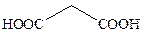
| 0,2 | |||
| Янтарная | 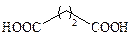
| 6,4 | 0,23 | ||
| Глутаровая | 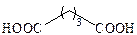
| 4,5 | 0,38 | ||
| Адипиновая | 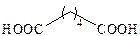
| 3,7 | 0,39 | ||
| Пимелиновая | 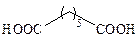
| 3.1 | 0,37 | ||
| Пробковая (субериновая) | 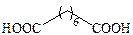
| 0,2 | 3,0 | 0,39 | |
| Азелаиновая | 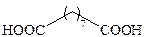
| 0,3 | 2,9 | 0,39 | |
| Себациновая | 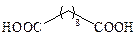
| 0,1 | 2,6 | 0,4 | |
| Малеиновая | 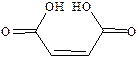
| 130,5 | 0,055 | ||
| Фумаровая | 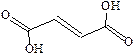
| 0,7 | 4,1 | ||
| Фталевая | 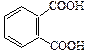
| 0,7 | 0,4 |
Таблица 27 – Поведение дикарбоновых кислот при нагревании
| Кислота | Формула | Ткип., °С | Продукты реакции |
| Щавелевая | 
| 160–180 | СО2 + HCOOH |
| Малоновая | 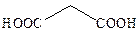
| 140–160 | СО2 + СН3СООН |
| Янтарная | 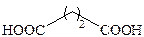
| 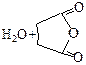
| |
| Продолжение таблицы 27 | |||
| Глутаровая | 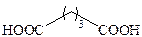
| 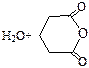
| |
| Адипиновая | 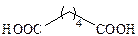
| 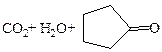
| |
| Пимелиновая | 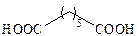
| 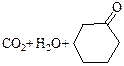
| |
| Фталевая | 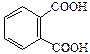
| 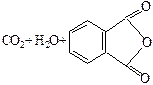
|
Высокие температуры плавления кислот по сравнению с температурами плавления и кипения спиртов и хлоридов, по-видимому, обусловлены прочностью водородных связей. При нагревании дикарбоновые кислоты разлагаются с образованием различных продуктов.
Химические свойства. У двухосновных кислот сохраняются все общие для карбоновых кислот свойства. Дикарбоновые кислоты превращаются в соли и образуют те же производные, что и монокарбоновые (галогенангидриды, ангидриды, амиды, сложные эфиры), но реакции могут идти как по одной (неполные производные), так и по обеим карбоксильным группам. Механизм реакций образования производных тот же, что и у монокарбоновых кислот.
Двухосновные кислоты обнаруживают также ряд особенностей, обусловленных влиянием двух СООН-групп.
1. Кислотные свойства. У дикарбоновых кислот по сравнению с предельными одноосновными кислотами повышены кислотные свойства (средние константы ионизации, таблица 26). Причиной этого является не только дополнительная диссоциация по второй карбоксильной группе, поскольку ионизация второго карбоксила протекает значительно труднее и вклад в кислотные свойства второй константы едва заметен.
Электроноакцепторная группа, как известно, вызывает увеличение кислотных свойств карбоновых кислот, так как повышение положительного заряда на карбоксильном атоме углерода способствует усилению мезомерного эффекта р,π-сопряжения, что, в свою очередь, усиливает поляризацию связи О–Н и облегчает ее диссоциацию. Этот эффект выражен тем больше, чем ближе друг к другу расположены карбоксильные группы. Токсичность щавелевой кислоты связана, прежде всего, с ее высокой кислотностью, величина которой приближается к таковой у минеральных кислот. Учитывая индуктивный характер влияния, понятно, что в гомологическом ряду дикарбоновых кислот кислотные свойства резко убывают по мере удаления карбоксильных групп друг от друга.
Дикарбоновые кислоты ведут себя как двухосновные и образуют два ряда солей – кислые (с одним эквивалентом основания) и средние (с двумя эквивалентами):


2. Реакции нуклеофильного замещения. Дикарбоновые кислоты, подобно монокарбоновым, вступают в реакции нуклеофильного замещения с участием одной или двух функциональных групп и образуют функциональные производные – сложные эфиры, амиды, хлорангидриды.
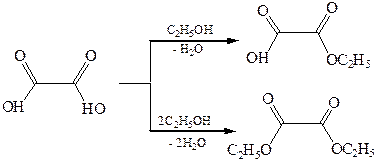
За счет высокой кислотности самой щавелевой кислоты ее сложные эфиры получают без применения кислотных катализаторов.
3. Специфические реакции дикарбоновых кислот. Взаимное расположение карбоксильных групп в дикарбоновых кислотах существенно влияет на их химические свойства. Первые гомологи, в которых СООН-группы сближены, – щавелевая и малоновая кислоты – способны при нагревании отщеплять оксид углерода (IV), в результате чего удаляется карбоксильная группа. Способность к декарбо-ксилированию зависит от строения кислоты. Монокарбоновые кислоты теряют карбоксильную группу труднее, только при нагревании их солей с твердыми щелочами. При введении в молекулы кислот ЭА заместителей склонность их к декарбоксилированию возрастает. В щавелевой и малоновой кислотах вторая карбоксильная группа выступает в качестве такого ЭА и тем самым облегчает декарбоксилирование.
– Конец работы –
Эта тема принадлежит разделу:
ОБЩИЕ ЗАКОНОМЕРНОСТИ СТРОЕНИЯ И ХИМИЧЕСКОГО ПОВЕДЕНИЯ ОКСОСОЕДИНЕНИЙ
Карбонильные соединения подразделяют в зависимости от... числа карбонильных групп в молекуле и присутствия других функциональных... монокарбонильные соединения...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Общие способы получения дикарбоновых кислот
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов