рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Реакции нуклеофильного присоединения
Реферат Курсовая Конспект
Реакции нуклеофильного присоединения
Реакции нуклеофильного присоединения - раздел Химия, ОБЩИЕ ЗАКОНОМЕРНОСТИ СТРОЕНИЯ И ХИМИЧЕСКОГО ПОВЕДЕНИЯ ОКСОСОЕДИНЕНИЙ 1.1 Присоединение Магнийалкилов: ...
1.1 Присоединение магнийалкилов:
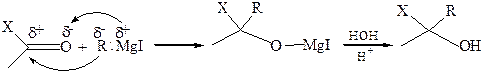
где Х = Н, Alk
Вследствие большой полярности связи Сδ––Мgδ+ магнийорганические соединения – довольно сильные нуклеофилы, поэтому реакция протекает очень легко. Образующийся продукт присоединения (алкоголят) при разложении водой превращается в соответствующий спирт.
1.2 Присоединение бисульфита натрия. Анион SО3– является сильным нуклеофилом, поэтому реакция альдегидов с NаHSО3 протекает очень легко в отсутствие катализаторов при энергичном встряхивании с насыщенным водным раствором соли:
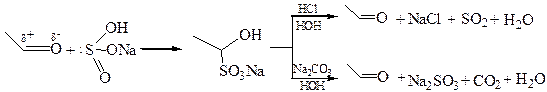
Бисульфитные производные легко кристаллизуются, не растворяются в избытке бисульфита, легко регенерируют исходное карбонильное соединение при нагревании с разбавленной кислотой или содой. Поэтому эту реакцию используют:
· как качественную на альдегиды;
· для выделения альдегидов из смесей или с целью их очистки.
В ряду кетонов эта реакция возможна только для наименее пространственно затрудненных соединений типа метилкетонов.
1.3 Присоединение синильной кислоты. Синильная кислота – слабодиссоциирующее соединение и. соответственно, плохой источник цианид-иона как нуклеофила. Поэтому в этой реакции используют основные катализаторы, которые способствуют отщеплению протона и образованию цианид-аниона.
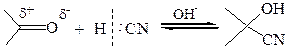
Присоединение цианид-иона к кетонам протекает труднее, чем к альдегидам, а с ароматическими кетонами типа Аr–СО–Аr цианид-ионы практически не реагируют. Синтетическая ценность этой реакции заключается в возможности удлинения углеродной цепи на один атом и получения гидроксикарбоновых кислот.
1.4 Присоединение воды. Вследствие того, что вода – слабый нуклеофил, реакция обратима, и положение равновесия определяется строением субстрата, т. е. реакционной способностью карбонильного соединения:
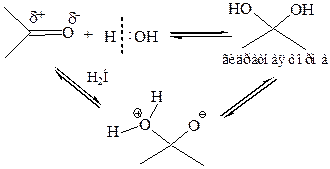
1.5 Присоединение спиртов. Эта реакция протекает по той же схеме, что и присоединение воды:
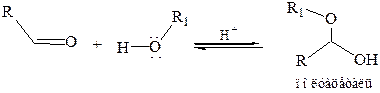
Спирт, как и вода, – слабый нуклеофил, поэтому образование полуацеталей характерно только для альдегидов. Полуацетали – обычно неустойчивые соединения, их нельзя выделить из спиртовых растворов. Если эту реакцию проводить в присутствии кислого катализатора при нагревании и избытке спирта, полуацеталь превращается далее в устойчивую форму – ацеталь:
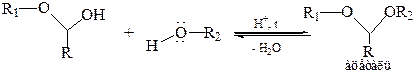
Образование ацеталя – SN1, реакция ОН-группы полуацеталя. Ацетали представляют собой простые гем-эфиры, однако, в отличие от обычных простых эфиров, связь С–О в ацеталях менее прочная, и они легко гидролизуются в кислой среде до исходных карбонильных соединений. Однако ацетали устойчивы к гидролизу основаниями, поэтому образование ацеталей – метод защиты альдегидной группы от действия оснований.
Кетоны, как менее реакционноспособные соединения, обычно не реагируют с простыми спиртами, однако с 1,2-диолами образуют циклические производные – кетали:
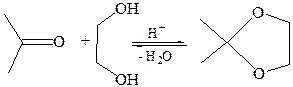
2. Реакции с N-нуклеофилами (реакции присоединения-отщепления). К числу N-нуклеофилов (азотистых оснований) относятся аммиак NН3 и ряд его производных с общей формулой NH2–X, например, NH2–R, NH2–NH2, NH2–NH–Аr, NH2–ОН и др. Обычно используют кислые катализаторы для активации субстрата и дегидратации аддукта. Однако в сильнокислой среде азотистые основания превращаются в соли и теряют нуклеофильные свойства, поэтому каждую конкретную реакцию следует проводить при оптимальном значении рН среды. Учитывая кислый катализ, механизм взаимодействия карбонильного соединения с азотистым основанием можно представить следующим образом:
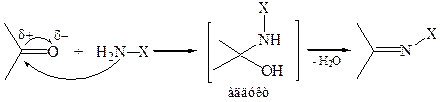
Как видно из схемы, на лимитирующей стадии протекает типичная для карбонильных соединений AN реакция. Однако промежуточный аддукт неустойчив, так как энергия двух простых связей C–N и С–О (305,9 + 356,2 = 662,1 кДж/моль) больше энергии двойной связи C=N (615,9 кДж/моль). Следовательно, энергия аддукта относительно велика и поэтому легко протекает его дегидратация. Таким образом, реакции карбонильных соединений с N-нуклеофилами можно рассматривать как нуклеофильное замещение атома кислорода карбонильной группы (SN).
2.1 Образование иминов и оксимов:
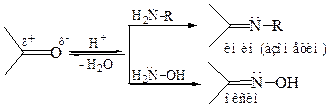
При реакции самого аммиака с карбонильными соединениями образуются неустойчивые и склонные к полимеризации имины. Имины, содержащие хотя бы один ароматический заместитель у карбонильного углерода (Аr–СН=N–R), являются устойчивыми продуктами. Они известны как основания Шиффа (часть 2, глава 2).
2.1.1Гидролиз иминов. Имины легко гидролизуются в кислой или щелочной среде, что позволяет отделить карбонильные соединения от соединений других классов и выделить их в чистом виде:
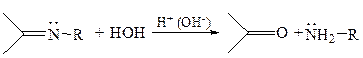
2.1.2Гидролиз оксимов. Оксимы, как и многие производные карбонильных соединений, в водных растворах кислот могут подвергаться гидролизу, регенерируя исходное карбонильное соединение и гидроксиламин. В присутствии сильных кислот альдоксимы могут подвергаться дегидратации:
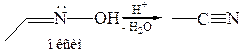
2.2.3 Перегруппировка Бекмана (1886 г.). Оксимы кетонов под действием сильных кислот (концентрированной H2SO4, полифосфорной кислоты) или РОСl3, РСl5 претерпевают перегруппировку с образованием амидов кислот:
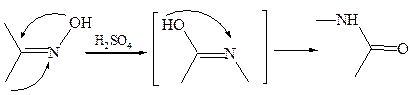
Следует отметить две характерные особенности механизма перегруппировки:
· миграция углеводородного заместителя и разрыв связи N–О протекают как одновременный процесс, так что атом азота не получает в процессе реакции полного положительного заряда;
· в протонированном оксиме обычно мигрирует R-группа, находящаяся в транс-положении к ОН-группе.
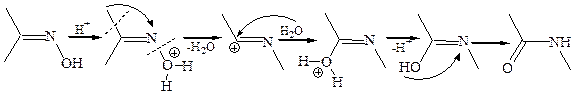
Оксимы, как и все другие продукты взаимодействия карбонильных соединений с N-нуклеофилами, благодаря π-связи могут существовать в виде цис-транс-изомеров, называемых в отличие от алкенов син- и анти-формами. Роль второго заместителя у атома азота выполняет электронная пара. Если ОН-группа и меньший заместитель находятся по одну сторону плоскости π-связи, этот изомер называют син-изомером, а если по разные стороны – анти-изомером.
Получающиеся амиды легко гидролизуются с образованием первичного амина и карбоновой кислоты, поэтому эта реакция дает возможность по структре установить строение исходного кетона, а также конфигурацию оксимов. Кроме того, перегруппировка Бекмана может быть использована в синтезе амидов, первичных аминов и кислот, в частности, нашла применение в промышленности перегруппировка оксима циклогексанона с целью получения капролактама – исходного соединения для производства полиамидного синтетического волокна капрон:
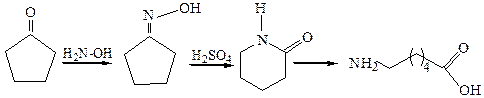
2.2 Образование гидразонов:
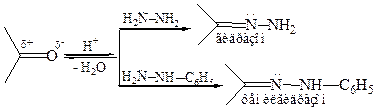
2.3 Реакция Кижнера–Вольфа (1911 г.). Гидразоны при нагревании со щелочами или алкоголятами расщепляются с выделением азота и образованием углеводорода:
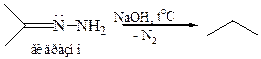
3. Реакции с галогенцентрированными нуклеофилами. Альдегиды и кетоны при взаимодействии с РСl5 образуют геминальные дигалогенуглеводороды через внутримолекулярное нуклеофильное замещение:
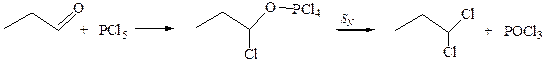
4. Реакции восстановления альдегидов и кетонов. Альдегиды и кетоны могут быть восстановлены в зависимости от условий реакции до соответствующих спиртов либо углеводородов, если в молекуле имеются связи С=С, С≡С, C≡N, то они в присутствии катализаторов восстанавливаются легче, чем карбонильная группа. Каталитическое гидрирование альдегидов и кетонов приводит к соответствующим спиртам (катализаторы – Ni, Рt, Рd):
– Конец работы –
Эта тема принадлежит разделу:
ОБЩИЕ ЗАКОНОМЕРНОСТИ СТРОЕНИЯ И ХИМИЧЕСКОГО ПОВЕДЕНИЯ ОКСОСОЕДИНЕНИЙ
Карбонильные соединения подразделяют в зависимости от... числа карбонильных групп в молекуле и присутствия других функциональных... монокарбонильные соединения...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Реакции нуклеофильного присоединения
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов