рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Электродные потенциалы и электродвижущие силы
Реферат Курсовая Конспект
Электродные потенциалы и электродвижущие силы
Электродные потенциалы и электродвижущие силы - раздел Химия, ХИМИЯ По изучению дисциплины и задания для контрольных работ Если При Проведении Окислительно-Восстановительной Реакции Процессы Окисления...
Если при проведении окислительно-восстановительной реакции процессы окисления и восстановления разделить в пространстве, а переход электронов от восстановителя к окислителю проводить по внешней цепи, то полученное устройство называется гальваническим элементом (Г.Э.).
Обычно Г.Э.составляется из двух разнородных металлов,погруженных в растворы одноименных с этими металлами солей. Растворы сообщаются друг с другом через пористые перегородки. Генерация постоянного электрического тока осуществляется за счет различия природы металлов, из которых составлен Г.Э. Система «металл-раствор соли» называется электродом. Электрод, на котором идет процесс восстановления, называется катодом, на котором идет процесс окисления, называется анодом.
Существуют Г.Э., в которых генерация постоянного электрического тока осуществляется за счет различия в концентрациях растворов соли металла. В этом случае электроды состоят из одного и того же металла, погруженного в растворы соли металла различной концентрации. Такие Г.Э. называют концентрационными.
Если внешняя цепь в Г.Э. разомкнута, то электрический ток не вырабатывается, а на каждом электроде устанавливается динамическое равновесие, формируется двойной электрический слой между поверхностью металла и раствором соли. Таким образом, на поверхности каждой из пластинок создается определенная электрическая напряженность (т.е. имеет место скачок потенциала). Абсолютная величина этого скачка остается неизвестной, поэтому пользуются относительными значениями электродных потенциалов.
Стандартным электродным потенциалом металла называют электродный потенциал этого металла, возникающий при его погружении в раствор одноименной с ним соли с молярной концентрацией соли См(Men+) = 1 моль/л, измеренный по отношению к стандартному водородному электроду, потенциал которого при 25ºС принят равным нулю Еº(2Н+|Н2) = 0 В.
Если все металлы расположить в ряд по мере возрастания их стандартных электродных потенциалов (Еº), то получится «ряд напряжений» (или ряд активности, или ряд стандартных электродных потенциалов).
Положение того или иного металла в ряду активности характеризует его активность (т.е. восстановительную способность, как главное химическое свойство металлов). Чем меньше значение Еº(Меn+|Me), тем больше его активность (восстановительная способность).
Если пластинка металла погружена в раствор соли металла с концентрацией раствора отличной от 1 моль/л, то величина скачка потенциала на границе металл-раствор, рассчитывается по формуле Нернста:
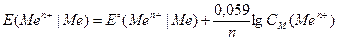 ,
,
где Еº – стандартный электродный потенциал (см. табл. 15) металла; n – число электронов, принимающих участие в процессе; См(Меn+) – молярная концентрация катионов металла в растворе соли.
Если обе металлические пластинки соединить проводником через гальванометр или через потребителя (например, электрическую лампочку), то по внешней цепи будет осуществляться ток электронов от более активного металла к менее активному. Таким образом, более активный металл является анодом, отдавая электроны менее активному металлу – катоду.
Гальванические элементы принято записывать схемой:
(анод) Me1|Me1n+ || Ме2m+|Ме2 (катод),
Me1 – более активный металл, Ме2 – менее активный металл. Вертикальная линия обозначает поверхность раздела между металлом и раствором его соли, а двойная линия – пористую перегородку между растворами двух солей. Для такого Г.Э. при прохождении тока осуществляются следующие процессы:
Ме1 – nē → Me1n+ (анод – процесс окисления)
Ме2m+ + mē → Me2 (катод – процесс восстановления)
Электродвижущая сила (ЭДС) Г.Э. – максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента. Реальное напряжение всегда меньше ЭДС, т.к. работа обратима, только если процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала.
Пример. Записать уравнения анодного и катодного процессов, происходящих при работе Г.Э., составленного из пластинок магния и никеля, погруженных в растворы одноименных с ними солей с концентрациями CM(Mg2+) = 0,01M и CM(Ni2+) = 0,001M. Найти ЭДС данного элемента и записать суммарное уравнение процесса, проходящего в данном Г.Э.
Схема (Г.Э.): (анод) Mg|Mg2+ || Ni2+|Ni (катод).
Магний является анодом, т.к. он имеет меньший стандартный электродный потенциал. Таким образом, уравнения катодного и анодного процессов будут выглядеть следующим образом:
Mg – 2ē → Mg2+ (анод – окисление Mg)
Ni2+ + 2ē → Ni (катод – восстановление Ni2+)
Для расчета ЭДС (ΔЕ) следует иметь в виду, что ЭДС не может быть отрицательной величиной, поэтому:
ΔЕ = Е(кат.) – Е(ан.).
Электродные потенциалы катода и анода рассчитываются по уравнению Нернста:
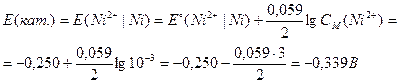
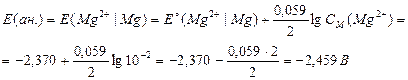
ΔЕ = Е(кат.) – Е(ан.) = –0,339В–(–2,459В) = 2,120В.
Уравнение ОВР, характеризующей работу данного Г.Э., получаем, сложив два электронных уравнения, подобно тому как складываются полуреакции (если необходимо, умножить уравнения на соответствующие множители для сокращения электронов):
Mg + Ni2+ → Mg2+ + Ni.
Суммарное уравнение в молекулярном виде может быть таким:
Mg + NiSO4 = Ni + MgSO4.
– Конец работы –
Эта тема принадлежит разделу:
ХИМИЯ По изучению дисциплины и задания для контрольных работ
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РФ... Кафедра неорганической химии...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Электродные потенциалы и электродвижущие силы
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов