рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Гидролиз солей
Реферат Курсовая Конспект
Гидролиз солей
Гидролиз солей - раздел Химия, ХИМИЯ По изучению дисциплины и задания для контрольных работ Гидролизом Солей Называют Реакции Ионного Обмена Между Молекулами Растворенно...
Гидролизом солей называют реакции ионного обмена между молекулами растворенной соли и молекулами воды с образованием слабого электролита (т.е. молекул или ионов слабого электролита).
Студентам рекомендуется основательно проработать по учебным пособиям соответствующие параграфы и приобрести навыки для записи процессов гидролиза солей по шагам:
1. Составить уравнение электролитической диссоциации соли.
2. Определить, по какому из ионов идет гидролиз соли. Гидролиз идет по иону, образованному из слабого электролита. Список сильных кислот и оснований приведен выше (см. раздел «Кислоты и основания.
3. Написать для выбранного иона уравнение взаимодействия с одной молекулой воды. Данное уравнение и будет главной записью гидролиза соли – сокращенным ионным уравнением гидролиза. Уравнение демонстрирует наступившее в растворе равновесие и характеризуется собственной константой равновесия – константой гидролиза (КГ.). На этом этапе возможно определить характер среды, возникающей в растворе – создается: либо кислая, либо щелочная реакция среды. В случае, когда соль образована слабой кислотой и слабым основанием, реакция среды будет близкой к нейтральной (т.е. pН ≈ 7).
4. Написать уравнение гидролиза в молекулярном виде. При этом за основу берется ионное уравнение, а для составления молекул используются ионы противоположного знака (противоионы) из уравнения диссоциации соли (см. шаг 1).
Пример.Составить уравнение гидролиза хлорида меди (II).
1. Диссоциация соли: CuCl2 = Cu2+ + 2Cl–.
2. Известно, что катиону Cu2+ соответствует слабое основание, а иону Cl– – сильная кислота. Таким образом, гидролиз идет по катиону.
3. Уравнение гидролиза: Cu2+ + HOH ↔ (CuOH)+ + H+. Закономерно, что положительный катион Cu2+ притягивает к себе из молекулы воды отрицательную частицу OH– и образуется составной катион с зарядом +1. Связывание катионом Cu2+ частиц OH– приводит к накоплению в растворе избытка ионов H+ и, следовательно, в результате гидролиза в растворе создается кислая среда.
Осталось записать выражение для константы гидролиза:
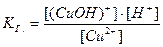 .
.
4. При составлении уравнения в молекулярной форме, надо увидеть, что всем положительным ионам соответствуют имеющиеся в растворе в свободном виде отрицательные ионы Cl–. С учетом зарядов ионов составляем электронейтральные молекулы и подбираем коэффициенты:
CuCl2 + HOH ↔ Cu(OH)Cl + HCl.
– Конец работы –
Эта тема принадлежит разделу:
ХИМИЯ По изучению дисциплины и задания для контрольных работ
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РФ... Кафедра неорганической химии...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Гидролиз солей
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов