рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Запитання до семінару
Реферат Курсовая Конспект
Запитання до семінару
Запитання до семінару - раздел Химия, До семінарських занять з предмету: Хімія 1. Який Відсоток Складає Вміст Кисню В Атмосфері Землі? 2. Напишіть ...
1. Який відсоток складає вміст кисню в атмосфері Землі?
2. Напишіть формулу калій пероксиду.
3. Яке має співвідношення водень з киснем у суміші “гримучий газ”?
4. Назві та напишіть тип кристалічної гратки кисню.
5. Назвіть фізичні властивості кисню.
6. Напишіть формули речовин, в яких оксиген виявляє ступінь окиснення –2.
7. Обчисліть та вкажіть масу калій перманганату, що містить 1,25% домішок, необхідну для добування 2,24л кисню.
8. Які властивості характерні для сірководню?
9. Напишіть формулу піриту.
10. Напишіть ступінь окиснення сульфуру у сполуці, що утворюється при згорянні сірководню в надлишку кисню.
11. Напишіть ступінь окиснення сульфуру у сполуці, що утворюється при взаємодії сульфур (ІV) оксиду з киснем в присутності каталізатора.
12. Обчисліть та вкажіть масу (в кг) сульфатної кислоти, яку можна добути,використовуючи 0,4т піриту, що містить 25% домішок.
13. Які властивості виявляє сульфур триоксид?
14. Напишіть рівняння реакції взаємодії сульфур триоксиду з водою.
15. Який тип зв’язку існує в молекулі сульфур триоксиду?
16. Який тип зв’язку існує в молекулі сульфур (ІV) оксиду?
17. Назвіть фізичні властивості сульфур диоксиду.
18. Обчисліть та вкажіть масу (в грамах) сульфур (VІ) оксиду, який можна добути з сульфур (ІV) оксиду об’ємом 112л, якщо вихід продукту реакції від теоретично можливого складає 90%.
19. Напишіть рівняння реакції взаємодії концентрованої сульфатної кислоти з міддю.
20. Напишіть рівняння реакції взаємодії сульфатної кислоти з карбонатом натрію.
21. Яка супінь окиснення сульфуру у сульфатній кислоті?
22. Напишіть рівняння реакції взаємодії концентрованої сульфатної кислоти з ортофосфатною кислотою.
23. Яку роль відіграє сульфатна кислота у окисно-відновних реакціях?
24. Які гази можна сушити пропусканням через концентровану сульфатну кислоту?
25. Яка речовина використовується для лабораторного добування азоту?
26. Напишіть формулу калійної силітри.
27. За допомогою, яких речовин можна добути в лабораторних умовах амоніак?
28. Назві та напишіть тип кристалічної гратки азоту.
29. Назвіть фізичні властивості азоту.
30. Яку ступінь окиснення можуть виявляти атоми нітрогену?
31. Обчисліть та вкажіть масу амоніаку (в грамах), який можна добути з 448л азоту, якщо вихід продукту реакції від теоретично можливого складає 62,5%.
32. Яка ступінь окиснення нітрогену в сполуці, що утворюється при згорянні амоніаку в надлишку кисню у присутності каталізатора?
33. Який ступінь окиснення виявляє нітроген у оксидах?
34. Назвіть фізичні властивості нітроген діоксиду.
35. Який ступінь окиснення має нітроген в нітратній кислоті?
36. Напишіть рівняння реакції взаємодії нітратної кислоти з концентрованою сульфатною кислотою.
37. Яку роль відіграє нітратна кислота у окисно-відновних реакціях?
38. Якого кольору набуває лакмус у присутності амоніаку?
39. Яка ступінь окиснення атому нітрогену в амоніаку?
40. Тривіальна назва водного розчину амоніаку.
41. В якому агрегатному стані за звичайних умов існує амоніак?
42. Назвіть фізичні властивості амоніаку.
43. Які властивості характерні для фосфору?
44. Алотропна модифікація, утворена фосфором, що займається на повітрі.
45. Алотропна модифікація, утворена фосфором, що уявляє собою воскоподібну речовину.
46. Назві та напишіть тип кристалічної гратки білого фосфору.
47. Напишіть формулу преципітату.
48. Назвіть фізичні властивості білого фосфору.
49. Які властивості характерні для карбону?
50. Напишіть формулу питної соди.
51. Назвіть фізичні властивості алмазу.
52. Обчисліть та вкажіть масу осаду (в грамах), що випадає при змішуванні розчину натрій силікату об’ємом 200 мл з масовою часткою солі 21,35% та розчину ферум (ІІ) сульфату об’ємом 0,5л з масовою часткою солі 6,08%.
53. В якому агрегатному стані за звичайних умов існує силіцій оксид?
54. Назвіть властивості кремнію, що широко використовуються у електротехніці.
55. Обчисліть та вкажіть об’єм вуглекислого газу (в літрах), який можна добути з вапняку масою 500г, що містить 10% домішок.
Семінар № 3
Тема: Загальні відомості про метали.
Мета: Закріпити знання студентів про положення металів у періодичній системі. Поглибити знання студентів про фізичні та хімічні властивості металів. Закріпити навички студентів складати рівняння реакцій; розв’язувати задачі за рівняннями хімічних реакцій.
Література: 1. М.В. Горский “Обученые основам общей химии” М. Просвещение 1991.
2. І.Г. Хомченко “Загальна хімія” Київ “Вища школа” 1993 р.
Методичні вказівки.
Із 110 відомих хімічних елементів 88 є металами. Елементи першої – третьої групи (крім водню та бору), а токаж елементи побічних підгруп четвертої – восьмої груп – метали. У головній підгрупі четвертої групи більшість елементів (за винятком кремнію та вуглецю) теж є металами. У головній підгрупі п’ятої групи знаходяться два метали (сурма та вісмут), а у головній підгрупі шостої групи – один (полоній).
Метали в твердому стані – кристалічні речовини з металічним типом зв’язку. У перехідних металах зв’язок між атомами частково є ковалентним.
У природі метали існують переважно у вигляді сполук – оксидів (Fe3O4, Fe2O3), сульфідів (ZnS, PbS, FeS2), сульфатів (CaSO4, BaSO4), хлоридів (KCl, NaCl), карбонатів (CaCO3, FeCO3, ZnCO3), фосфатів (Ca3(PO4)2) і нітратів (NaNO3, KNO3).
У вільному стані в земній корі трапляються лише метали, які в ряду стандартних електродних потенціалів знаходяться праворуч від водню – мідь, ртуть, срібло, золото, платина.
Усі метали, крім ртуті та францію, за звичайної температури – це тверді речовини кристалічної будови. У кристалічному стані вони добре відбивають світло і тому непрозорі, мають характерний металічний блиск. Найкраще відбивають світло індій та срібло, тому їх використовують для виготовлення дзекал у прожекторах і рефлекторах. Майже всі метали (за винятком золота та міді) мають білий або сірий колір з різними відтінками. У порошко-подібному стані більшість металів набувають чорного або темно-сірого кольору. Усі метали добре проводять електричний струм і теплоту. Найкращі провідники електричного стуму та теплоти – срібло і мідь.
Метали – пластичні речовини. Пластичність – це здатність легко змінювати форму під дією зовнішніх сил і зберігати одержану форму після припинення цієї дії.
Найбіль пластичний метал – золото. З нього можна приготовляти дуже тонку фольгу і тягнути тонкі нитки. Характерні фізичні властивості металів пояснюються особливостями їх внутрішньої структури: наявністю електронного газу – вільних електронів.
Густина, температури плавління, кипіння та твердість металів залежать від їх індивідуальних властивостей – маси атома, заряду ядра, міцності металічного зв’язку.
За густиною метали поділяють на легкі, густина яких не перевищує 5000 кг×м-3 (літій, натрій, магній, алюміній тощо), і важкі з густиною понад 5000 кг×м-3 (цинк, залізо, мідь, ртуть тощо). За температурами плавлення розрізняють легкоплавкі та тугоплавкі метали. Найнижчу температуру плавління має ртуть (-38,87 0С), найвищу – вольфрам (3410 0С). За твердістю метали поділяють на тверді та м’які. Найтвердішими є хром і вольфрам, найм’якшими – натрій, калій та індій.
За іншими ознаками розрізняють такі метали: чорні (залізо, марганець, хром), кольорові (усі інші), рідкісні (літій, рубідій, цезій, берилій, молібден, вольфрам, цирконій, гафній, ванадій, ніобій, тантал та ін.), рідкісноземельні (скандій, ітрій, лантан і лантаноїди), розсіяні (галій, індій, талій і германій), лужні (літій, натрій, калій, рубідій, цезій, францій), лужноземельні (кальцій, стронцій, барій, радій), благородні (золото, срібло, платина, паладій, родій, іридій, рутеній та осмій), радіактивні (технецій, прометій, полоній, францій, радій, актиній та актиноїди) тощо.
Метали добувають з їх сполук на металургійних заводах. Спочатку їх відновлюють, а потім відокремлюють від інших речовин. Усі промислові способи одержання металів засновані на окисно-відновних реакціях.
Пірометалургійні способи полягають у відновленні металів з оксидів за високих температур за допомогою вуглецю, оксиду вуглецю (ІІ), алюмінію, кремнію або водню:
ZnO + C Þ Zn + CO;
Fe3O4 + 4CO Þ 3Fe + 4CO2;
Cr2O3 + 2Al Þ Al2O3 + 2Cr;
3BaO + Si Þ BaSiO3 + 2Ba;
WO3 + 3H2 Þ W + 3H2O.
Якщо метал одержують з сульфідів, ці сполуки перетворюють на оксиди (випалювання):
2ZnS + 3O2 Þ 2ZnO + 2SO2;
4FeS2 + 11O2 Þ 2Fe2O3 + 8SO2;
Cu2S + 2O2 Þ 2CuO + SO2.
Як відновник у реакціях використовують сульфід того ж металу (економія окисників і відновників):
2ZnO + ZnS Þ 3Zn + SO2,
 3 Zn+2 + 2 е ® Zn0
3 Zn+2 + 2 е ® Zn0
S-2 – 6 е ® S+4
Гідрометалургійні способи засновані на реакціях переведення сполук металів у розчин і відновлення з них металів без застосування високих температур за допомогою електролізу або інших металів:
CuО + H2SO4 Þ CuSO4 + H2O;
CuSO4 + Fe Þ FeSO4 + Cu.
Гідрометалургійними способами одержують золото, срібло, цинк, уран тощо.
Електрохімічні способи засновані на реакціях відновлення металів електролізом розплавів їх солей, оксидів або гідроксидів. Цими способами одержують лужні та лужноземельні метали. алюміній тощо.
| Відновлення металів | |||
| Вугіллям та оксидом вуглецю (ІІ) | Електричним струмом (електроліз) | Алюмінієм (алюмінотерапія) | Воднем |
+2 2e 0 0 +2
ZnO + C 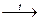 Zn + CO
+3 6e +2 0
Fe2O3 + 3CO Zn + CO
+3 6e +2 0
Fe2O3 + 3CO 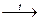 2Fe +
+4
+ 3CO2 2Fe +
+4
+ 3CO2
| NiSO4 ® Ni2+ + SO42+ HOH Û H+ + OH- На аноді: ОН- -е ® ОН0 0 4ОН ® 2Н2О + О2 На катоді: Ni2+ + 2е ® Ni0 | 0 12e +4
4Al + 3MnO2 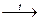 +3 0
® 2Al2O3 + 3Mn
+3 0
® 2Al2O3 + 3Mn
| +6 6e 0 0
WO3 + 3H2 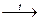 W +
+1
+ 3H2O
+2 2e 0 0
CoO + H2 W +
+1
+ 3H2O
+2 2e 0 0
CoO + H2 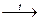 Co +
+1
+ H2O Co +
+1
+ H2O
|
Під дією факторів навколишнього середовища метали окислюються, утворюючи хімічні сполуки (оксиди, гідроксиди, солі) – зазнають корозії.
Корозія – це руйнування металів внаслідок їх взаємодії з навколишнім середовищем. Розрізняють хімічну та електрохімічну корозії.
Хімічна корозія – це руйнування металу внаслідок взаємодії з середовищем, яке не проводить елекричний струм. Прикладами хімічної корозії є швидке окислення на повітрі натрію або кальцію, взаємодія металів з сірководнем, галогенами, оксидом сірки (ІV) та іншими газами, що містяться в атмосфері, а також з рідинами, які не проводять електричний струм (нафтою, бензином, толуолом та ін.).
Електрохімічна корозія – це руйнування металу, що знаходиться в контакті з іншим металом і електролітом або водою.
Чисті метали не зазнають електрохімічної корозії.
Корозія завдає великих збитків народному господарству.
Методи захисту металів від корозії дуже різноманітні. Їх можна поділити на три групи.
1. Захист поверхні металу від впливу факторів навколишнього середовища за допомогою покриттів – металічних (нікелю, цинку, хрому, алюмінію, золота, срібла) або неметалічних (лаків, фарб, смол, гуми, емалей), плівки оксиду – оксидування, плівки солей – фосфатування.
2. Обробка корозійного середовища. З середовища, де знаходяться метали, видаляють речовини, які викликають корозію, або додають такі, що уповільнюють корозію - інгибітори.
3. Електрохімічні методи – катодний і протекторний захисти. Їх використовують у середовищах, які добре проводять електричний струм. Для забезпечення катодного захисту поверхонь (труб, парових котлів, корпусів кораблів) виріб підключають до катода (анодом є лист заліза). За певної сили струму окисник відновлюється на катоді, анод окислюється, що забезпечує стійкість виробу до корозії.
Лужні метали – це форма існування у вільному стані таких елементів, що ксладають головну підгрупу першої групи періодичної системи. Лужними вони називаються тому, що їх гідроксиди є сильними лугами.
У ряду стандартних електродних потенціалів лужні метали розташовані ліворуч і мають найменші з усіх металів значення. Це зумовлює такі властивості лужних металів: - їх атоми є сильними відновниками, а позитивні іони – дуже слабкими окисниками;
- вони – найактивніші метали, що витісняють водень не тільки з кислот – слабких окисників, а й з води;
- ці метали не можна одержати електролізом водних розчинів їх солей;
вони не витісняють інші метали з водних розчинів їх солей.
Прості речовини кальцій, стронцій, барій, радій називають лужно-земельними металами, оскільки їх гідроксиди мають лужні властивості, а їх тугоплавкі оксиди раніше називали землями. Іноді лужноземельними помилково називають усі елементи головної підгрупи другої групи.
На s-підрівні зовнішнього енергетичного рівня атоми елементів мають по два електрони. Це s2-елементи. У хімічних сполуках вони виявляють стурінь окислення +2.
За фізичними властивостями метали головної підгрупи близькі до лужних. У вільному стані – це сріблясто-білі речовини з металічним блиском, твердіші за лужні метали, з більшими густинами, температурами плавлення та кипіння. За густиною всі вони, за винятком радію, належать до легких металів.
– Конец работы –
Эта тема принадлежит разделу:
До семінарських занять з предмету: Хімія
МІНІСТЕРСТВО ОСВІТИ І НАУКИ МОЛОДІ ТА СПОРТУ УКРАЇНИ... ОДЕСЬКИЙ ТЕХНІЧНИЙ КОЛЕДЖ... ОДЕСЬКОЇ НАЦІОНАЛЬНОЇ АКАДЕМІЇ ХАРЧОВИХ ТЕХНОЛОГІЙ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Запитання до семінару
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов