рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Величина постоянная при данной температуре.
Реферат Курсовая Конспект
Величина постоянная при данной температуре.
Величина постоянная при данной температуре. - раздел Химия, Конспект лекций по курсу ОБЩАЯ ХИМИЯ 1. Основные законы химии 1 Чем Меньше Пр, Тем Менее Растворима Соль. Значения Пр При Ста...
Чем меньше ПР, тем менее растворима соль. Значения ПР при стандартных условиях приводятся в справочниках.
ЗАДАЧА. Рассчитать растворимость (L) соли AgCl в воде при стандартных условиях.
Равновесие в насыщенном растворе описывается уравнением: AgCl¯ Û Ag+ + Cl-
Из справочника: ПР (AgCl) = [Ag+] × [Cl -] = 1,73×10-10 , [Ag+] = [Cl -] = Ö ПР, тогда
концентрация соли в растворе С (AgCl) = [Ag+] = Ö 1,73×10-10 = 1,32×10-5 моль/л.
Растворимость соли – это масса соли в 100 г воды. Поскольку концентрация соли мала,
можно считать, что m(раствора) @ m(Н2О). Один литр воды имеет массу 1000 г (r = 1 г/см3)
Тогда L = С (AgCl)×М(AgCl)×100/1000 = 1,32×10-5×143/10 = 1,89×10-4 г/100г воды.
Условие выпадения осадка.
Для того, чтобы осадок начал образовываться, необходимо достигнуть насыщенного состояния раствора, т.е. когда произведение активных концентраций взаимодействующих ионов (с учетом соответствующих степеней) будет равно или больше произведения растворимости. Например, малорастворимая соль состава АnBm будет выпадать из раствора, если выполняется условие :
аn (А)×аm(B) ³ ПР или без учета ионной силы раствора С n(А)× Сm (В) ³ ПР.
ЗАДАЧА. Будет ли образовывать осадок Ag2SO4, если смешать равные объемы растворов
AgNO3 0,1 моль/л и Na2SO4 0,01 моль/л?
Из справочника: ПР(Ag2SO4) = а2(Ag+)×a(SO42-) = 1,6×10-5
Концентрация ионов серебра в растворе AgNO3 С(Ag+) = 0,1 моль/л.
Концентрация сульфат-ионов в растворе Na2SO4 С(SO42-) = 0,01 моль/л.
Поскольку смешали равные объемы растворов, то концентрация каждого уменьшилась в 2
раза, т.е. после смешивания растворов С(Ag+) = 0,05 моль/л, а С(SO42-) = 0,005 моль/л..
Проверяем условие выпадения осадка: C2(Ag+)×C(SO42-) = 0,052×0,005 = 1,25×10-5 < ПР.
Следовательно, осадок не образуется.
Реакции в растворах электролитов
Химические реакции в растворах электролитов протекают между ионами. Те реакции, которые идут без изменения степеней окисления элементов, называются ионообменными.
Для выявления характера протекающих процессов их записывают в ионно-молекулярной форме по следующему правилу: слабые электролиты, осадка, газы записываются в виде молекул, а сильные электролиты – в виде ионов.
ПРИМЕР. Ве(ОН)2¯ + 2 НС1 = ВеС12 + 2 Н2О
осадок сильный эл-т сильный эл-т слабый эл-т
Ве(ОН)2¯ + 2Н+ + 2С1- = Ве2+ + 2С1- + 2Н2О, после сокращения получим:
Ве(ОН)2¯ + 2Н+ = Ве2+ + 2Н3О, видно, что осадок гидроксида бериллия может быть
растворен в любой сильной кислоте.
Ионно-молекулярное уравнение четко отражает суть проходящего процесса.
Все реакции между электролитами обратимы, но равновесие может быть смещено в ту или другую сторону. Например, PbSO4¯ + Na2S = PbS¯ + Na2SO4
белый осадок черный осадок
PbSO4¯ + S2- = PbS¯ + SO42-
¾¾¾®
Равновесие данного процесса сдвинуто вправо, т.к. ПР(PbS)< ПР(PbSO4), что означает меньшую растворимость PbS по сравнению с PbSO4.
Выводы: 1) равновесие любой обменной реакции смещается в сторону образования менее
диссоциирующего вещества;
2) обменные реакции, в которых образуются труднорастворимые соединения, выделяются
газообразные вещества или образуются слабодиссоциирующие электролиты, протекают
практически до конца.
Ионизация воды. Водородный показатель.
Электропроводность химически чистой воды ничтожно мала. Она обусловлена присутствием в воде ионов гидроксония и гидроксила (в очень малых количествах):
H2O …….H2O = H3O+ + OH- ,
или упрощенно Н2О = Н+ + ОН-
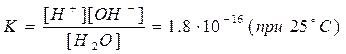 |
Процесс дисоциации (ионизации) воды обратимый, равновесный, характеризуется константой равновесия:
При таком малом значении константы можно считать, что концентрация недиссоциированных молекул практически равна исходной концентрации воды. При температуре 25°С плотность воды
r@1 г/см3, масса 1 литра воды – 1000 г, концентрация воды С(Н2О)@[H2O] = 1000/18 = 55,5(5) моль/л. Тогда, [H+]×[OH-] = K×[H2O] = 1,8×10-16×55,5(5) = 1×10-14.
Выражение КВ (или КW) = [H+]×[OH-]=const = 1×10-14 (при 25°С) – назывется ионное произведение воды
(или константа автопротолиза)
В любом водном растворе ионное произведение воды есть величина постоянная для данной температуры. Следовательно, в любом водном растворе (кислоты, щелочи, соли) концентрации
Н+-ионов или ОН- -ионов не могут быть равны нулю. Рассмотрим несколько примеров.
ПРИМЕРЫ. 1) В воде [H+] = [OH-] = Ö КВ = 1×10-7 моль/л рН = -lg[H+] = 7, нейтральный раствор.
2) Раствор 0,1 моль/л NaOH – это сильный электролит, диссоциирует полностью,
[OH-] = 0,1 моль/л, [H+] = КВ / [OH-] = 1×10-14/0,1 = 1×10-13 моль/л, рН = 13, щелочной р-р.
3) Раствор 0,001 моль/л НС1 – это сильная кислота, диссоциирует полностью,
[H+] = 0,001 моль/л, рН = 3, кислотный раствор.
В любом водном растворе всегда есть ионы Н+ и ОН- за счет ионизации воды. Концентрации их взаимосвязаны. Для того, чтобы описать характер раствора (кислый, нейтральный, щелочной) достаточно знать концентрацию ионов Н+ или водородный показатель рН = -lg[H+]. Из ионного произведения воды следует, что в любом водном растворе рН + рОН = 14, где рОН = -lg[OH-].
Шкала рН. -1 0 7 14
рН < 7 рН > 7
кислая среда щелочная среда
Величину рН измеряют с помощью индикаторов (растворов и бумаги) и приборов рН-метров.
Индикаторы – растворы слабых органических кислот или оснований, у которых молекула и сложный органический ион имеют разную окраску, например, индикатор фенолфталеин –слабая кислота, в растворе частично диссоциирует: HInd Û H+ + Ind-
бесцветный красный
Избыток ОН- ¾¾¾¾¾¾¾¾¾¾®
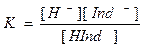 |
¬¾¾¾¾¾¾¾¾¾¾ Избыток Н+
Поскольку каждый индикатор имеет свое значение константы ионизации, то переход окраски происходит при определенном значении рН. Для фенолфталеина рН перехода окраски 9.
Универсальный индикатор – смесь индикаторов, которой пропитывают бумагу.
Как приборы, так и индикаторы фиксируют не истинную концентрацию ионов Н+, а активную, поэтому рН = -lg aH , и только в очень разбавленных растворах рН = -lgCн.
– Конец работы –
Эта тема принадлежит разделу:
Конспект лекций по курсу ОБЩАЯ ХИМИЯ 1. Основные законы химии 1
для студентов кафедр ПФМ ИЭФ ЭФ... физико технического факультета УГТУ УПИ... Составили доценты кафедры физико химических методов анализа...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Величина постоянная при данной температуре.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов