рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Конспект лекций по курсу ОБЩАЯ ХИМИЯ 1. Основные законы химии 1
Реферат Курсовая Конспект
Конспект лекций по курсу ОБЩАЯ ХИМИЯ 1. Основные законы химии 1
Конспект лекций по курсу ОБЩАЯ ХИМИЯ 1. Основные законы химии 1 - раздел Химия, Конспект Лекций По Курсу “Общая Химия” Для Студенто...
Конспект лекций по курсу “ОБЩАЯ ХИМИЯ”
для студентов кафедр ПФМ, ИЭФ, ЭФ
физико-технического факультета УГТУ-УПИ.
Составили: доценты кафедры физико-химических методов анализа
Л.Б. Хамзина, С.Ю.Пальчикова
Оглавление страница
Введение 1
1. Основные законы химии 1
2. Энергетика химических процессов 2
3. Химическая кинетика и равновесие 6
4. Основные характеристики растворов 11
5. Строение атома и систематика химических элементов 21
6. Химическая связь и строение молекул 30
7. Электрохимические процессы 36
8. Окислительно-восстановительные реакции 44
9. Свойства р-элементов 51
10. Металлы 57
11. Комплексные соединения 66
12. Лантаниды и актиниды 71
ВВЕДЕНИЕ
Химия относится к естественным наукам, изучающим окружающий нас мир. Химия изучает состав и строение веществ, зависимость их свойств от состава и строения, а так же пути превращения одних веществ в другие. Химия занимается также синтезом веществ, неизвестных в природе: фтороуглероды, пластмассы, силиконы и т.д.
Под веществом мы имеем в виду любой вид материи, обладающий при определнных условиях постоянными химическими и физическими свойствами.
В настоящее время число известных соединений порядка 7 млн., из них более 300 тыс. соединений – неорганических. Число возможных реакций между ними настолько велико, что вряд ли они могут быть описаны все. Поэтому очень важным является знание общих закономерностей химических процессов.
Превращение веществ всегда сопровождается физическими явлениями: выделением света, тепла, электроического тока и др., поэтому химия тесно связана с физикой (квантовая химия, хемотроника, физическая химия, радиохимия).
В данном курсе рассматриваются следующие разделы: строение атомов и молекул, твердых тел и растворов, начальные сведения о химической термодинамике и кинетике, свойства растворов, основы электрохимии и коррозии, химические свойства наиболее распространенных элементов и их соединений, в том числе и элементов конца Периодической системы – лантанидов и актинидов.
Курс «Химия» включает 46-48 часов лекций и 56-60 часов практических и лабораторных занятий. В конце курса – ЗАЧЕТ и ЭКЗАМЕН. Программа курса утверждена методическим Советом физико-технического факультета.
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Материл этого раздела, включающий понятия: моль, молярая масса вещества, законы газообразного состояния вещества, расчеты по химическим уравнениям, вынесен на самостоятельное изучение с последующим контролем на практических занятиях.
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
Любое химическое превращение веществ связано с перестройкой электронных структур атомов, ионов и молекул, которая сопровождается различными энергетическими эффектами –… Энергетические эффекты реакций изучает термохимия(раздел химический термодинамики).Стандартные энтальпии образования простых веществ равны нулю!!!
Рассмотрим реакцию:
Ca(к) + C (т) + 3/2O2(г) = CaCO3(т) DH° º DH°обр. CaCO3 = -1207 кДж/моль
Уравнение химической реакции с указанием теплового эффекта называют термохимическимуравнением. Как видно из уравнения, возможны дробные коэффициенты и, как правило, указание агрегатного состояния реагирующих веществ.
Закон Гесса.
Герман Иванович Гесс, профессор Петербургского университета, в 1841г. сформулировал закон, который лежит в основе всех термодинамических расчетов.
Тепловой эффект зависит только от состояния исходных и конечных продуктов, но не
Зависит от пути процесса, т.е. от числа и характера промежуточных стадий.
ПРИМЕР. Образование диоксида углерода СО2 из графита и кислорода можно рассматривать либо как одностадийный процесс: С(графит) + О2 = СО2 , DН1… либо как двухстадийный: 1 стадия С(графит) +1/2 О2 = СО , DН2 (2),Возможность и направленность процесса. Энтропия. Свободная энергия Гиббса.
При любой химической реакции молекулы исходных веществ разрушаются, что требует определнной затраты энергии. При образовании новых молекул (новых… Понижение энергии системы назовем энергетическим или энтальпийным фактором. … Однако утверждать, что только экзотермические реакции (DH < 0) могут протекать самопроизвольно, нельзя. Среди…Энтропия чистого совершенного кристалла при абсолютном нуле равна нулю (третий закон термодинамики).
ПРИМЕР. Н2О(кр) Н2О(ж) Н2О(г)ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
О принципиальной осуществимости процесса судят по значению изменения энергии Гиббса системы. Однако, оно ничего не говорит о реальной возможности… Химическая кинетика – наука о скоростях и механизмах протекания химических… изучает влияние температуры, давления, концентрации реагентов и катализатора на скорость химической реакции, что…При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Коэффициент k называется константой скорости реакции, не зависит от концентрации реагирующих веществ, зависит от природы реагирующих веществ, температуры и наличия в системе катализатора.
Численно константа скорости соответствует скорости при единичных концентрациях (удельная скорость). Размерность константы скорости зависит от молекулярности реакции.
Закон действующих масс применим только к элементарным реакциям. Сложные реакции протекают через ряд промежуточных стадий и стехиометрическое уравнение не соответствует молекулярности реакции, а отражает суммарный процесс.
ПРИМЕР. 2Н2О2 = 2Н2О + О2, по закону действующих масс u = k× C2 ( Н2О2), что не
соответствует экспериментальным данным, согласно которым u = k× C ( Н2О2
Дело в том, что процесс идет в две стадии: 1) Н2О2 = Н2О + О и 2) О + О = О2
Первая стадия, как более медленная, определяет скорость суммарного
процесса.
Зависимость скорости реакции от концентрации реагирующих веществ, установленная опытным путем, называется кинетическим уравнением. Сумма показателей при концентрациях в кинетическом уравнении называется порядком реакции. Так, реакция разложения пероксида водорода есть реакция первого порядка. В отличие от молекулярности порядок реакции может быть и дробным, и нулевым.
В гетерогенных системах скорость реакции относится к единице поверхности и не зависит от концентрации твердой фазы.
ПРИМЕРЫ. 2Mg + O2 = 2MgO, u = k× C (O2) – реакция первого порядка
СаСО3 (к) = СаО (т) + СО2, u = k = const – рекция нулевого порядка
Зависимость скорости реакции от температуры. Энергия активации.
Согласно правилу Вант-Гоффа, сформулированного на основе опытных данных, для большинства химических реакций скорость возрастает примерно в 2¸4 раза при повышении температуры накаждые 10 градусов.
u t = u0 × a Dt/10 или kt = k × a Dt/10 , где а= 2¸4 – температурный коэффициент реакции.
Какова причина столь значительного влияния температуры на скорость химических реакций?
На первый взгляд это можно было бы объяснить тем, что при повышении температуры скорость движения частиц возрастает, увеличивается число их соударений, в том числе и эффективных соударений, приводящих к взаимодействию. Однако, как показывают расчеты, при повышении температуры от 0° до 100 °С скорость движения молекул увеличивается примерно в полтора раза, тогда как скорость реакции – в 1000 раз (если принять а = 2).
Главная причина заключается в том, что при повышении температуры резко возрастает число активных молекул, обладающих достаточной энергией для перегруппировки связей в момент столкновения. Только при столкновении активных молекул происходит перераспределение электронной плотности и образование новых молекул, т.е. столкновения являются эффективными.
Этот процесс требует затраты времени и энергии. Мгновенных процессов в природе вообще не существует. Следовательно, любая система в ходе химических превращений переходит из начального состояния в конечное через какое-то промежуточное (переходное) состояние:
[ начальное ] ¾¾¾¾¾® [ переходное ] ¾¾¾¾¾® [ конечное ]
ослабление перераспределение образование новых
химических связей элктронной плотности химических связей
Например, для реакции H2 + J2 = 2HJ, путь реакции можно представить следующим образом:
H J H………J H ¾ J
½ + ½ ¾¾¾¾® M M ¾¾¾¾® +
H J H………J H ¾ J
активированный комплекс
Переходное состояние системы отвечает образованию так называемого активированного комплекса. В активированном комплексе как бы объединены “полуразрушенные “ молекулы H2, J2 и “полуобразовавшиеся” молекулы HJ. Активированный комплекс существует очень короткое время (~ 10-13 с). Его распад приводит к образованию молекул HJ, либо молекул H2, J2. Образование активированного комплекса требует определенной затраты энергии, но затраты гораздо меньшей, чем в случае полного разрыва химических связей в исходных молекулах и образования отдельных атомов (см. рис. 12). Затем при распаде активированного комплекса энергия выделяется. Если выделяется больше, чем было затрачено на образование активированного комплекса, то реакция экзотермическая (DН < 0), в противном случае – эндотермическая (DН > 0).
Рис.1. Энергетическая схема хода реакции H2 + J2 = 2HJ
Энергия, необходимая для перехода веществ в состояние активированного комплекса, называется энергией активации Еа (или энтальпией активации DНа ). Энергия активации – это своеобразный энергетический барьер реакции, который должны преодолеть молекулы, чтобы произошло взаимодействие между ними. Молекулы, обладающие избыточным количеством энергии (по сравнению со средней величиной при данной температуре), достаточным для преодоления энергетического барьера реакции, называются активными.
Чем больше активных молекул в реакционной системе, тем выше скорость реакции. В любой газовой системе вследствие хаотического движения молекул энергия распределяется неравномерно. Кривая распределения Максвелла-Больцмана, приведенная на рис.2, позволяет определить количество активных молекул в системе при данной температуре (заштрихованная область).
Рис.2. Распределение молекул в системе по энергиям при разных температурах
Из рисунка видно, что число молекул с энергией, превышающей Еа , резко возрастает с повышением температуры. Обычно рост температуры в арифметической прогрессии приводит к увеличению числа активных молекул, а, следовательно, и скорости реакции в геометрической прогрессии.
Зависимость скорости реакции от температуры и энергии активации определяется выражением
константы скорости реакции:
k = A × e -Ea/RT (уравнение Аррениуса).
Сомножитель А учитывает также вероятность надлежащей ориентации молекул при столкновении:
A = Z × e DSa/RT, где DSа – энтропия активации,
e DSa/RT – стерический фактор,
Z – множитель, отражающий общее число столкновений в единицу времени.
Влияние катализатора на скорость химической реакции.
Одним из распространенных в химической практике методов ускорения химических реакций является катализ. Катализ – это ускорение химической реакции веществом катализатором, активно участвующим в промежуточных стадиях реакции, но выходящим из этой реакции химически неизменным. Благодаря этому катализатор многократно повторяет реакцию с новыми порциями веществ, поэтому небольшие количества катализатора оказывают большое воздействие. Катализатор изменяет путь реакции за счет образования промежуточных соединений между катализатором и исходными веществами и снижения энергии активации каждой отдельной стадии, что приводит к увеличению скорости всей реакции в целом.
ПРИМЕР
Рассмотрим реакцию А + В = АВ, которая имеет высокую энергию активации Еа и протекает поэтому с очень малой скоростью. При введении в систему третьего вещества К (катализатор), которое легко вступает во взаимодействие с А, образуется соединение АК:
A + K ¾® A……K ¾® AK, для этой стадии Еа¢<< Еа.
активированный комплекс
Соединение АК далее легко взаимодействует с веществом В, образуя вещества АВ и К:
В + АК ¾® В…….АК ¾® АВ + К , для этой стадии Еа²<< Еа.
активированный комплекс
Суммарная реакция будет: А + В = АВ, т.е. катализатор остался без изменения, энергия активации реакции снижается на величину DЕ, скорость реакции возрастает, хотя процесс протекает в две стадии.
Рис.3. Энергетическая схема хода реакции в присутствии катализатора
В зависимости от агрегатного состояния катализатора и реагирующих веществ различают катализ гомогенный и гетерогенный.
В случае гомогенного катализа реагирующие вещества и катализатор представляют гомогенную систему (реагирующие вещества газообразные и катализатор – газ).
ПРИМЕР. Реакция получения серного ангидрида 2SO2 + O2 = 2SO3, катализатор – NO.
1 стадия O2 + 2NO = 2 NO2
2 стадия SO2 + NO2 = SO3 + NO
В случае гетерогенного катализа реагирующие вещества и катализатор представляют разные фазы, реакция идет на поверхности катализатора.
ПРИМЕР.
Реакция получения серного ангидрида 2SO2 + O2 = 2SO3, катализатор – V2O5 или Pt.
Механизмы химических реакций.
1. Молекулярный Н2 + I2 = 2 HI E активации = 150¸450 кДж/моль
2. Ионный Ag+ + Cl- = AgCl 0 ¸ 80
3. Радикальный (цепные реакции) Н2 + С12 = 2НС1 0 ¸ 40
Радикалы – валентно ненасыщенные частицы: атомы, молекулы, осколки молекул NO, H, O, CH3 и др. Основной признак свободного радикала – наличие холостого электрона, который и обуславливает высокую реакционную способность частицы. Появление в смеси одного радикала приводит к возникновению цепи последовательных превращений и реакция быстро охватывает весь реакционный объем. Таким образом протекают в частности реакции горения.
ПРИМЕР.
Смесь водорода и хлора в темноте может храниться очень долго, скорость реакции мала.
При освещении вспышкой магния происходит взрыв реакционной смеси. Идет цепная реакция: Сl2 +hn® Cl(×) + H2 = HCl + H(×) + Cl2 = HCl + Cl(×) и т.д.
Cl(×) + H2 = …….
Cl(×), H(×) – радикалы, атомы с одним непарным электроном.
Реакция прекращается на стенке сосуда или на частице большей массы, которая забирает избыточную энергию и электрон. Такова роль триэтилсвинца при горении бензина в двигателях внутреннего сгорания.
Химическое равновесие.
Химические реакции бывают обратимые и необратимые. Подавляющее большинство химических реакций – обратимые, т.е. начиная протекать в одном направлении, затем идут в обоих направлениях (за счет взаимодействия как исходных веществ, так и продуктов реакции). Обратимые реакции не протекают до конца.
Совершенно необратимых реакций очень мало, например:
2H2O2 = 2H2O + O2 – разложение пероксида водорода,
2KClO3 = 2KCl + 3O2 – разложение бертолетовой соли,
Pb(N3)2 = Pb + 3N2 - разложение азида свинца.
Вопросы химического равновесия могут быть рассмотрены только для обратимых реакций. Рассмотрим обратимую реакцию в общем виде aA + bB = dD + eE.
Скорость прямой реакции uпрямой = k1CAaCBb. По мере расходования исходных веществ скорость
прямой реакции уменьшается.
Скорость обратной реакции uобратной = k2CDd CEe. По мере накопления продуктов реакции скорость
возрастает.
Через некоторое время t скорости прямой и обратной реакций станут равны, что соответствует состоянию химического равновесия.
Рис.4. Изменение скорости в ходе реакции
Истинное равновесие является динамическим, подвижным. Это означает, что при наступлении равновесия как прямая, так и обратная реакция продолжают идти. Но наблюдатель, находящийся вне системы, увидит, что реакция как бы остановилась, поскольку концентрации всех веществ перестанут меняться. Сколько, например, вещества А расходуется в ходе прямой реакции, столько же его и образуется в ходе обратной. Концентрации веществ в условиях равновесия (моль/л) называют равновесными концентрациями и обозначают в квадратных скобках.
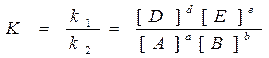 |
В условиях равновесия uпрямой = uобратной, из чего следует, что отношение констант скоростей прямой и обратной реакций есть величина постоянная:
Величину К – называют константой равновесия. Этой величине не приписывают никакой размерности, но концентрации обязательно молярные (моль/л). Она характеризует глубину протекания реакции. Зависит от природы реагирующих веществ и температуры. Она связана с изменением стандартной энергии Гиббса уравнением: DG0 = -RT lnK. Большим отрицательным значениям DG0<< 0 отвечают большие значения К>>1, т.е. прямая реакция протекает в значительной степени и в равновесной смеси преобладают продукты реакции. При больших положительных значениях DG0>>0 константа равновесия К<<1, что означает, что прямая реакция практически не протекает.
В случае гетерогенных реакций концентрация твердой фазы в выражение константы равновесия не входит.
Для выражения состояния равновесия в реакциях с участием газообразных веществ часто вместо концентраций используют равновесные парциальные давления реагентов.
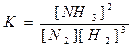 |
ПРИМЕРЫ. 1) N2 + 3H2 = 2NH3
2) CaCO3(т) = CaO(т) + CO2, K = [CO2] или K = p (CO2}
Смещение равновесия.
Поскольку химическое равновесие подвижное, то при внешних воздействиях (изменении С, р, Т) оно нарушается, концентрация всех веществ в системе будет изменяться до тех пор, пока не установится новое положение равновесия. Если внешнее воздействие убрать, то система возвращается в исходное равновесное состояние.
Принцип Ле-Шателье. Если изменить одно из условий, при которых система находится в равновесии (С, р, Т), то равновесие смещается в сторону протекания той реакции, которая ослабляет воздействие.
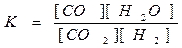 |
ПРИМЕРЫ. CO2 + H2 = CO + H2O(г)
CO2 + H2 = CO + H2O(г) Увеличим концентрацию СО2. Это вызовет уменьшение
концентрации Н2 и увеличение концентраций СО и Н2О до тех пор,
С(СО2) ¾¾® пока их новые соотношения не будут снова равны К.
N2 + 3H2 = 2NH3 Увеличим давление. Система стремится ослабить внешнее воздействие, т.е.
Р ¾¾¾® уменьшить число молей в системе. Начнет протекать прямая реакция до тех
пор, пока не установится новое положение равновесия.
N2O4 = 2NO2, DH > 0 Увеличим температуру. Поскольку процесс эндотермический, т.е. в ходе
Т ¾¾® реакции тепло поглощается, то увеличение температуры будет
способствовать протеканию прямой реакции.
Влияние катализатора. Катализатор ускоряет в одинаковой степени и прямую и обратную реакции, поэтому на полноту протекания процесса (на выход реакции) он не влияет, но сокращает время установления равновесия.
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ РАСТВОРОВ
Раствором называется гомогенная однородная дисперсная система, состоящая не менее чем из двух компонентов – растворителя и растворенного вещества. … Растворитель по фазе совпадает с раствором. Растворяемое вещество может быть в любой фазе (Г, Ж, Т).Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором
где ро – давление насыщенного пара растворителя при данной температуре, р –давление пара растворителя над раствором,Законы Рауля: повышение температуры кипения и понижение температуры замерзания
Разбавленных растворов неэлектролитов пропорциональны моляльной
Концентрации растворенного вещества и не зависят от природы вещества.
DTзам = К × сm , где сm – моляльная концентрация растворенного вещества, [моль/кГ растворителя], DТкип = Tкип (раствора) - Ткип (растворителя)Концентраций ионов этого электролита в соответствующих степенях есть
Величина постоянная при данной температуре.
Чем меньше ПР, тем менее растворима соль. Значения ПР при стандартных условиях приводятся в справочниках. ЗАДАЧА. Рассчитать растворимость (L) соли AgCl в воде при стандартных условиях.ГИДРОЛИЗ СОЛЕЙ
Гидролизу подвергаются соли, содержащие в своем составе: 1) анион слабой кислоты; 2) катион слабого основания (NH4+ и катионы других металлов, кроме щелочных и Ca2+, Sr2+, Ba2+);СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
К середине Х1Х века было открыто свыше 60 элементов, определены их атомные веса, накоплен обширный экспериментальный материал по изучению их… В 1869 г. Менделеев сформулировал Периодический закон: «Свойства простых тел,… Перед учеными встала задача – раскрыть физический смысл периодического закона. В конце Х1Х века были получены…Электрон в поле ядра может двигаться только по определенным стационарным круговым орбитам без излучения энергии.
Рис.6. Иллюстрация теории БораИзменение свойств элементов в свете Периодического закона Д.И.Менделеева
С увеличением заряда ядра атомов наблюдается закономерное изменение в их электронной структуре, что приводит к закономерному изменению химических и… Изменение химических свойств. При химическом взаимодействии атомов любых… Элементы, расположенные в одной подгруппе ПСЭ, имеют одинаковую структуру одного (электронные аналоги) или двух…ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
При взаимодействии атомов образуются молекулы, кристаллы, полимерные структуры и т.д. – все вешества. Это взаимодействие сопровождается изменением электронной плотности, т.е.… Химическая связь, возникающая между атомами, есть результат перегруппировки электронов в поле ядер взаимодействующих…ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК
Атомная.В узлах атомы, связанные прочными ковалентными неполярными (простые вещества) или слабополярными (бинарные соединения) связями. Диэлектрики… T плавления, 0С С(алмаз) ~ 3500 Рис.20. Фрагмент кристаллической решетки алмазаЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
2. Процессы превращения электрической энергии в химическую – это процессы, протекающие при прохождении постоянного тока через раствор или расплав… Понятие об электродном потенциалеПри наложении минимальной разности потенциалов к электродам в
Первую очередь пойдет процесс, который характеризуется
Наибольшим потенциалом.
ПРИМЕР. В водном растворе находятся катионы Сu2+ , K+, Zn2+, среда нейтральная. Конкурирующие процессы на катоде Значения …На аноде в первую очередь идут те реакци, которые характеризуются
Наименьшими электродными потенциалами.
Кислород на всех электродах, кроме Pt, выделяется с перенапряжением,
Е(О2/2Н2О) @ +1,8 В (в любой среде).
Кислородсодержащие анионы NO3-, SO42- и др. при электролизе разбавленных
Водных растворов, не участвуют в анодных процессах, поскольку
Характеризуются очень высокими потенциалами. Вместо них идет процесс
Разложения воды с выделением кислорода.
а) из Pt, б) угольный, в) цинковый (среда нейтральная). А) Конкурирующие реакции: 2Cl- - 2e = Cl2 , E0 = +1,36ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Реакции, протекающие с изменением степеней окисления участвующих в реакции элементов, называются окислительно-восстановительными реакциями… Рассмотрим реакцию: 0¯ -1 0 -1 Cl2 + 2KJ = J2 + 2KClСВОЙСТВА р-ЭЛЕМЕНТОВ
______________________________________________________________________________________ Группа IIIA IVA VA VIA VIIA VIIIA s2p1 s2p2 s2p3 s2p4 s2p5 s2p6По группе По периоду
½ r, потенциал ионизации ¯, r¯, увеличивается число электронов на внешнем слое, ½ усиливается способность потенциал ионизации , усиливается… ½ отдавать электроны (ЭО¯), присоединять электроны (ЭО), усиливаютсяСтепень окисления
-1 +1 +3 +5 +7
___________________________________________________________________________
H[HF]
HCl HClO HClO2 HClO3 HClO4
Хлорноватистая хлористая хлорноватая хлорная
HBr аналогичные кислоты брома
HJ аналогичные кислоты иода
___________________________________________________________________________________
Соли
Фториды
Хлориды гипохлориты хлориты хлораты перхлораты
Бромиды гипобромиты бромиты броматы пероброматы
Иодиды гипоиодиты иодиты иодаты периодаты
14243 14444444442444444444443 1442443
только ОВ – двойственность только
восстановительные (но преобладают окислительные свойства) окислительные
свойства свойства
Плавиковая кислота. (HF)2 Û H[HF2] Û H+ + HF2-, Kк = 6,7×10-4.
Согласно константе ионизации плавиковая кислота – электролит средней силы, но очень агрессивна, пары ее ядовиты.
Соли – фториды, ядовиты, большинство нерастворимы в воде, имеют низкие температуры кипения, летучи.
Плавиковая кислота растворяет стекло, поэтому раствор хранят в полиэтиленовой посуде:
SiO2 + 4HF = SiF4 + 2H2O, процесс автокаталитически ускоряется образующейся водой.
Соляная кислота. Концентрированный раствор кислоты имеет массовую долю НС1 в растворе w~35%. Обладает восстановительными свойствами за счет ионов С1- и окислительными за счет Н+.
Реагирует с металлами, стоящими левее водорода в ряду напряжений металлов, с выделением Н2 и образованием хлоридов металлов. С малоактивными металлами не реагирует.
2НС1 + Zn = H2 + ZnCl2
Концентрированная соляная кислота и ее соли (при высокой концентрации хлорид-ионов) реагирует с активными окислителями с выделением газообразного хлора.
HClконц. + сильный окислитель (KMnO4, MnO2, K2Cr2O7) ® / Cl2 + Mn2+, Cr3+/
Окислительные свойства кислородных соединений галогенов.
KJO4 + Cr(NO3)3 + щелочная среда ® / J-, CrO42- /
KJ + KJO3 = / J2 / - реакция конмутации
KCl + KСlO3 = / Cl2 / - реакция конмутации
Группа VI A (ns2np4)
Характерные степени окисления в соединениях –2, 0, +4, +6 (кроме кислорода).
Для кислорода устойчивая степень окисления (–2), неустойчивые (-1) в пероксиде водорода Н2О2 и других пероксидных соединениях и (+2) в соединении OF2.
Степени окисления
-2 +4 +6
H2O (ж)
Водные растворы
H2S (г) H2S Û H+ + HS- SO2 (г) H2SO3 SO3 H2SO4
Сероводород сероводородная к-та сернистый газ сернистая к-та серный газ серная кислота
сернистый ангидрид серный ангидрид
H2Se (г) селеноводородная к-та SeO2 H2SeO3 SeO3 H2SeO4
H2Te (г) теллуроводородная к-та TeO2 H2TeO3 TeO3 H2TeO4
123 1442443 123 123
газы с слабые кислоты слабые кислоты сильные кислоты
неприятным
запахом соли соли соли
халькагено- сульфиды сульфиты сульфаты
водороды селениды селениты селенаты
теллуриды теллуриты теллураты
Вода.
В молекуле воды атом кислорода находится в состоянии sp3 – гибридизации, но валентный угол немного меньше 1090 за счет эффекта отталкивания неподеленных электронных пар.
Рис.30. Орбитальная диаграмма и валентная схема молекулы воды.
В жидком и кристаллическом состояниях вода образует ассоциаты (Н2О)x за счет водородных связей.
Рис.31. Схема образования ассоциатов (Н2О)2, (Н2О)6 (снежинка), (Н2О)x (лед)
Рис.32. Зависимость плотности воды от температуры
Получение водородных соединений.
S + H2 =t= H2S
ZnS + H2SO4 = H2S + ZnSO4
2H2 + O2 =катализатор Pt= 2H2O - взрыв
гремучий газ
Восстановительные свойства сероводорода и сульфидов.
Na2S (или H2S) + окислитель (KMnO4, K2Cr2O7, Cl2) ® / SO42-, Mn2+, Cr3+, Cl- /
ОВ – двойственность сульфитов.
Na2SO3 + типичный окислитель (KMnO4, K2Cr2O7) + кислотная среда ® / SO42-, Mn2+, Cr3+ /
Na2SO3 + типичный восстановитель (Na2S) ® / S0¯ / - реакция конмутации
(выравнивания степеней окисления)
Серная кислота.
+2

 Получение: 4FeS2 + 11 О2 =t= 2Fe2O3 + 8SO2 пирит Fe
Получение: 4FeS2 + 11 О2 =t= 2Fe2O3 + 8SO2 пирит Fe
S ¾¾S
2SO2 + O2 =t= 2SO3 (катализатор V2O5 ) -1 -1
SO3 + H2O = H2SO4
Серную кислоту, в отличие от других кислот, можно получить с массовой долей 100% - это олеум.
В олеуме может растворяться еще некоторое количество серного ангидрида:
H2SO4 + SO3 = H2S2O7 – пиросерная кислота, существует только в кристаллическом состоянии:
H2S2O7 + H2O = 2H2SO4
Окислительные свойства серной кислоты.
В молекуле серной кислоты два окислителя – H+ и S (+6).
В разбавленной H2SO4 окислителем являются ионы водорода. Металлы, стоящие левее водорода, растворяются в разбавленной серной кислоте, при этом выделяется водород и образуется сульфат металла:
H2SO4 разб. + Mg = H2 + MgSO4
H2SO4 разб. + Сu ® реакция не идет
Концентрированная серная кислота –является сильным окислителем за счет S (+6), которая в ходе реакции восстанавливается до SO2, S, H2S (H2 не выделяется).
HBr + H2SO4 конц. ® / Br2, SO2 /
HJ + H2SO4 конц. ® / J2, H2S /
C + H2SO4 конц. ® / CO2, SO2 /
Металлы активные (Mg, Zn) + H2SO4 конц. ® / MgSO4, ZnSO4, H2S /
Металлы малоактивные (Cu) + H2SO4 конц. ® / CuSO4, SO2 /
Группа V A (ns2np3)
Возможные степени окисления от (-3) до (+5).
Соединения со степенью окисления элементов (-3).
Аммиак NH3, ион аммония NH4+, нитриды, фосфиды, арсениды и т.д.
Нитриды образуются при взаимодействии металлов и неметаллов с азотом при высоких температурах (хотя в обычных условиях азот инертен):
Na3N, Mg3N2, AlN, BN, Si3N4, Ge3N4, S4N4, Cl3N и др.
14444444442444444443
tпл ~ 2000-30000С
диэлектрики, полупроводники
BN – твердый как алмаз
Соединения с водородом.
 NH3 - аммиак
NH3 - аммиак
PH3 – фосфин очень ядовитые газы, некоторые с чесночным запахом;
AsH3 – арсин устойчивость молекул уменьшается
SbH3 - стибин
BiH3 - висмутин
Получение аммиака. 1) В промышленности: N2 + 3H2 = 2NH3,
T ~ 400-5000C, P = 3000 атм, катализатор сложного состава
2) В лабораторных условиях: любая соль аммония и щелочь
NH4+ + OH- ¾t® NH3 + H2O
Свойства аммиака. Хорошо растворяется в воде за счет образования водородных связей

 NH3×H2O H O
NH3×H2O H O
H N ××××× H H
H
В растворе - ассоциаты (NH3)х, например, H
H N ××××× H
H ××××× N H
H
Водный раствор аммиака проявляет свойства слабого основания:
NH3 + H2O = NH4+ + OH- , Kосновности = 1,75×10-5
Как любое основание, раствор аммиака взаимодействует с кислотами (реакция нейтрализации) и осаждает из растворов солей металлов труднорастворимые гидроксиды:
NH3×H2O + HCl = NH4Cl + H2O
соли аммония
хорошо раств. в воде
AlCl3 + 3NH3×H2O = Al(OH)3¯ + 3NH4Cl
Гидроксиды некоторых металлов растворяются в избытке аммиака вследствие комплексообразования: Cu(OH)2¯ + 4NH3×H2O = [Cu(NH3)4](OH)2
Аммиак и соли аммония проявляют восстановительные свойства за счет N (-3).
Термическое разложение солей аммония.
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O ö
NH4NO2 = N2 + 2H2O ý ОВ - реакции
NH4NO3 = N2O + 2H2O ø
NH4Cl = NH3 + HCl
Соединения с положительными степенями окисления.
Степени окисления
+1 +2 +3 +4 +5
N2O NO N2O3 NO2 N2O5
Веселящий газ азотистый ангидрид (бурый газ) азотный ангидрид
H2N2O2 HNO2 2NO2+H2O= HNO2+HNO3 HNO3
Азотноватистая азотистая азотная
Очень неустойчивая слабая сильная
Соли соли
14444444444444424444444444444443 142443 ОВ – двойственность Только окислит. СвойстваМЕТАЛЛЫ
Tпл., 0С 660 30 156 304 327 232 271 254 Все металлы имеют характерные физические свойства, которые связаны с особенностями металлического типа связи. В узлах…Химические свойства
Если атомы металлов отдают электроны, то они превращаются в положительнозаряженные ионы: Me0 - ne = Men+. Простых отрицательных ионов металлы не образуют! Восстановительную активность металлов можно оценить по значению потенциала ионизации или стандартного ОВ-потенциала…Металлотермическое восстановление.
Ti, Zr TiCl4(г) + 2Mg(ж) = Ti(губка) + 2MgCl2(ж) - магниетермия Cr, V, Mn Cr2O3 + 2Al = 2Cr + Al2O3 - алюминотермияЛегкие конструкционные металлы – Be, Mg, Al, Ti.
Большинство легких металлов характеризуются высокой химической активностью, поэтому в качестве конструкционных материалов используют четыре металла… Магний – используется как активный восстановитель в металлотермическом методе… Магний способен корродировать во влажном воздухе, поэтому в чистом виде в качестве конструкционного материала не…КОМПЛЕСНЫЕ СОЕДИНЕНИЯ
Среди сложных веществ, образованных из трех или более различных атомов, особую группу составляют комплексные соединения. Они образуются из более… Cu(OH)2¯ + 4NH3 = [Cu(NH3)4](OH)2 HgJ2¯ + 2KJ = K2 [HgJ4]ЛАНТАНИДЫ И АКТИНИДЫ
Общая характеристика f – элементов Эти элементы занимают особое положение в ПСЭ. Так, в 6 периоде за элементом La(№ 57), который находится в 3 группе…– Конец работы –
Используемые теги: Конспект, лекций, курсу, Общая, Химия, основные, законы, химии0.112
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Конспект лекций по курсу ОБЩАЯ ХИМИЯ 1. Основные законы химии 1
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов