Основные понятия термодинамики. Предмет термодинамики. Основные параметры состояния термодинамической системы

| ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение
высшего профессионального образования
«РОССИЙСКИЙ ЗАОЧНЫЙ ИНСТИТУТ ТЕКСТИЛЬНОЙ И ЛЕГКОЙ ПРОМЫШЛЕННОСТИ»
Филиал ГОУ ВПО «РосЗИТЛП» в г. Омске
Кафедра Общетехнических наук
УТВЕРЖДАЮ Заведующий кафедрой
_________________________ "______" ___________2008 г.
ТЕПЛОТЕХНика
Конспект лекций
Омск |
СОДЕРЖАНИЕ
Основные понятия термодинамики.. 2
Предмет термодинамики. 2
Историческая справка. 3
Основные параметры состояния термодинамической системы.. 5
Законы идеального газа. 7
Законы термодинамики. 11
Удельная теплоемкость газов. 19
Применение законов термодинамики к тепловым машинам 27
Второй закон термодинамики. 27
Третий закон термодинамики. 40
Характеристики водяного пара. 41
Тепловые циклы.. 43
Основные понятия термодинамики
Предмет термодинамики
Техническая термодинамика изучает законы взаимного превращения тепловой и механической видов энергии. «therme» – теплота и «dynamicos» – сила.
В дальнейшем область применения термодинамики расширилась. Появилась термодинамика химических и фазовых превращений, термодинамика электрических и магнитных явлений, термодинамика излучения.
Термодинамика – наука о методах исследования наиболее общих макроскопических свойств материальных тел, проявляющихся в процессах преобразования одного вида движения материи в другой.
Историческая справка
В 1824 г. французский инженер Сади Карно опубликовал первую работу по теории тепловых машин «Размышления о движущей силе огня». Экспериментальные работы Джоуля (1843 г.) и теоретические работы Р.Майера… В 1848 г. Гельмгольц разработал термодинамическую теорию гальванического элемента.Основные параметры состояния термодинамической системы
Параметры состояния – это макроскопические признаки, характеризующие такую систему и ее отношение к окружающим телам. Это, прежде всего температура, давлениеиобъем.
Температура является параметром, который существует только у термодинамически равновесных систем. Для систем, близких к равновесию, температура может приниматься только как приближенное понятие, а для неравновесных систем понятие температуры вообще лишено смысла.
В системе СИ температура измеряется в Кельвинах [K] и обозначается Т. Однако, в термодинамики часто пользуются внесистемной единицей температуры – градус по шкале Цельсия [0C]. В этом случае температуру обозначают буквой t. Связь между этими двумя единицами измерения:
T = t + 273,16 ≈ t + 273.
Давление – характеризует величину силы, действующей на единицу площади поверхности, на границе с термодинамической системой:
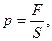 где F – сила, S – площадь.
где F – сила, S – площадь.
Единицей давления в системе СИ является Паскаль  .
.
Иногда давление измеряют в барах или атмосферах – 1 бар = 1 атм. = 1,033∙105 Па ≈ 105 Па. Реже используется миллиметр ртутного столба (мм рт. ст. или тор.) 760 мм рт. ст. ≈ 105 Па.
Объемобозначается буквой V и измеряется в м3. Внесистемная единица измерения объема – литр (1 литр = 10-3 м3). Часто удобнее пользоваться объемом единицы массы вещества. Этот параметр называется удельный объем, обозначается буквой v и измеряется в м3/кг. Величина, обратная удельному объему, представляет собой плотность вещества:
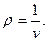
Энергия термодинамической системы
E = U + Eмех. Механическая энергия, в свою очередь, состоит из энергии кинетической и… E = U + Eк + Eп.Законы идеального газа
Уравнения состояния
Эту зависимость в общем виде можно записать так: F (p, V, T) = 0, где каждая из переменных является функцией двух других.Уравнение состояния идеального газа
Уравнение состояния (уравнение Менделеева – Клапейрона) для такого газа имеет вид: , (4) где m – масса газа, μ – его молярная масса, R – универсальная газовая постоянная (R= 8,314 Дж/моль град.).Законы термодинамики
Количество теплоты, подводимой к термодинамической системе, расходуется на изменение ее внутренней энергии и на работу по изменению объема… Q = ∆U + L (12) Работапо изменению объема газа.Первый закон термодинамики в дифференциальной форме
В термодинамике часто используется дифференциальная форма записи первого закона термодинамики:
δQ = dU + δL (13)
Работа, совершаемая на элементарном участке изменения объема dV, называется элементарной работой. Ее обозначение δL в выражении (13) означает, что элементарная работа не является полным дифференциалом какой-либо термодинамической функции. Чтобы пояснить смысл этого утверждения, рассмотрим коротко понятие «полного дифференциала».
Условие полного дифференциала
(14) Следовательно, для того чтобы выражениеВнутренняя энергия как функция состояния
Внутренняя энергия обладает полным дифференциалом, а следовательно является однозначной функцией состояния. Этот постулат подтверждают следующие рассуждения.
Предположим, что одному и тому же состоянию системы соответствует два различных значения внутренней энергии U1 и U2. Это значит, что часть энергии можно отнять у системы и при этом никаких изменений в системе не произойдет. Мы получим источник энергии, позволяющий построить вечный двигатель первого рода. Но это противоречит первому закону термодинамики, следовательно, сама предпосылка неверна.
Количество теплоты
Как видно из выражения (13), количество теплоты δQ, как сумма полного dU и неполного δL дифференциалов, не является полным дифференциалом.
Количество теплоты не характеризует состояние термодинамической системы, а представляет собой энергию, которая передается (отводится) термодинамической системе в процессе теплообмена. Количество теплоты является функцией термодинамического процесса.
Аналитическая формулировка первого закона термодинамики в форме выражения (13) справедлива как для обратимых, так и для необратимых процессов.
Для случая расширения идеального газа первый закон термодинамики запишется:
δQ = dU + p’dV (14)
Здесь p’ – внешнее давление, оказываемое на газ. Для равновесного процесса внешнее давление p’ равно давлению p в газе, и первый закон термодинамики для этого случая запишется в виде:
δQ = dU + p dV (15)
Обратимые и необратимые процессы
Квазистатическим называют процесс с малым отклонением от равновесного состояния. Это бесконечно медленный процесс, состоящий из ряда… 1. Равновесные процессы можно изображать графически в виде монотонной кривой.… 2.Равновесные процессы обладают свойством обратимости. Обратимыми называются процессы, которые могут проходить как в…Условия существования и свойства равновесных процессов.
2. Совершение в прямом процессе максимальной работы. 3. Бесконечно медленное течение процесса, связанное с бесконечно малой… 4. Абсолютные значения работ прямого и обратного процессов совпадают.Удельная теплоемкость газов
Q ~ m (T2 – T1) Введя коэффициент пропорциональности с, получим: Q = c m (T2 – T1), откудаСвязь между теплоемкостями при постоянном давлении и постоянном объеме.
U = f (V, T) Запишем полный дифференциал этой функции (24)Из первого закона термодинамики
Адиабатный процесс –это процесс без теплообмена с окружающей средой. (δQ = 0) Из первого закона термодинамики: δQ = m cv dT + p dV = 0 или m cv dT = - p dVПрименение законов термодинамики к тепловым машинам
Второй закон термодинамики
Таким образом, второй закон термодинамики дает ответ на вопрос о направлении процессов, происходящих в природе. Существует несколько формулировок второго закона термодинамики, имеющих один и… Теплота сама собой не может переходить от тела менее нагретого к телу более нагретому без одновременных изменений в…Вычисление энтропии. Парадокс Гиббса.
(48) Из уравнения состояния идеального газа или ,Рис. 11. Процесс перехода системы из состояния 1 в состояние 2 по разным путям
При анализе квазистатических процессов понятие энтропии может быть уяснено из уравнения  , определяющего дифференциал энтропии. Первый закон термодинамики устанавливает, что элемент теплоты δQ не является полным дифференциалом. Рассмотрим переход системы из состояния 1 в состояние 2 по путям I и II (рис.11). Количества теплоты, необходимые для перехода из состояния 1 в состояние 2 по этим путям соответственно равны:
, определяющего дифференциал энтропии. Первый закон термодинамики устанавливает, что элемент теплоты δQ не является полным дифференциалом. Рассмотрим переход системы из состояния 1 в состояние 2 по путям I и II (рис.11). Количества теплоты, необходимые для перехода из состояния 1 в состояние 2 по этим путям соответственно равны:
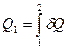 ,
, 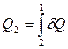
Согласно первого закона термодинамики Q1 ≠ Q2. Однако если количество теплоты δQi, получаемое системой на некотором элементе пути, разделить на температуру Ti, при которой сообщается эта теплота, и найти интегралы этих (приведенных) теплот по всему первому и всему второму пути, то для квазистатических процессов эти интегралы будут равны:
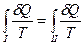 . (57)
. (57)
Это указывает на существование некоторой однозначной функции состояния, изменение которой определяется этим интегралом и называется энтропией:
 . (58)
. (58)
Второй закон термодинамики для нестатических процессов
Пусть переход системы из состояния 1 в состояние 2 (рис. 11) происходит нестатически. При этом системе сообщается некоторое количество теплоты… δQнест = dU + δLнест. (59) Если же система переходит из состояния 1 в состояние 2 квазистатически, тоТретий закон термодинамики
Планк высказал предположение, что при абсолютном нуле температуры энтропия не просто минимальна, а равна нулю. Постулат Планка:Энтропия правильно сформированного кристалла чистого вещества… Вещество должно быть обязательно чистым, а кристалл – лишенным дефектов.Характеристики водяного пара
Обычно пар получают в процессе кипения жидкости. Если подводить теплоту к жидкости при постоянном давлении, температура жидкости растет до… Кипение– это процесс парообразования в объеме жидкости, тогда как испарение… Процесс кипения в p – V диаграмме изображается изобарой, которая одновременно является и изотермой.Тепловые циклы
Замкнутый процесс, в котором в конечном итоге рабочее тело Замкнутый процесс, в котором в конечном итоге рабочее тело Цикл 1 – 2 – 3 – 4 – 1, в котором работа расширения больше работы сжатия, называется прямым цикломили циклом тепловой…Рис. 15. Обратный цикл Карно
Цикл Ренкина –это идеальный цикл паросиловой установки.
Иллюстрация цикла Ренкина с использованием p – V и T – S диаграммы представлена на рис. 16. На рис. 17 этот же цикл показан на i – S диаграмме.
Перегретый пар с начальным давлением р1 направляется в турбину, где расширяется по адиабате 1-2 до давления р2. Отработанный пар после турбины конденсируется при давлении p2 = const и tk = const в конденсаторе, отдавая
теплоту парообразования охлаждающей воде (процесс 2-3). Далее идет процесс 3-4 сжатия воды насосом. При этом будет некоторое повышение температуры. Так как оно мало, то часто этот участок не показывают. Процесс 4-5 - нагревание воды до температуры кипения. Процесс 5-6 - парообразование в котле. Процесс 6-1 - перегрев пара в пароперегревателе. Процесс 4-5-6-1 протекает при постоянном давлении p1 = const.
 |
Рис. 16. Цикл Ренкина в p-V и T-S диаграммах
Термический КПД цикла Ренкина:

 , где h = i1 – i2 - располагаемая работа (работа турбины); i1– энтальпия пара перед турбиной; i2 – энтальпия пара после турбины; i3’–энтальпия конденсата, которая берется по таблице сухого насыщенного пара и воды на кривой насыщения по давлению р3.
, где h = i1 – i2 - располагаемая работа (работа турбины); i1– энтальпия пара перед турбиной; i2 – энтальпия пара после турбины; i3’–энтальпия конденсата, которая берется по таблице сухого насыщенного пара и воды на кривой насыщения по давлению р3.
Рис. 17. Цикл Ренкина в i – S диаграмме