рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Лабораторно-практические занятия № 11, 12
Реферат Курсовая Конспект
Лабораторно-практические занятия № 11, 12
Лабораторно-практические занятия № 11, 12 - раздел Образование, Рекомендуется в качестве пособия Тема: Физиологически Активные Гетерофункциональные Производные Бензоль...
Тема: Физиологически активные гетерофункциональные производные бензольного и гетероциклического ряда.
Цель: Закрепить знания строения и химических свойств основных представителей лекарственных соединений бензольного ряда и физиологически активных гетероциклических соединений.
Исходный уровень:
1. Строение гетероциклических соединений – пиррола, имидазола, пиридина, пиримидина, пурина. Электронное строение пиррольного и пиримидинового азота.
2. Кислотность и основность органических соединений.
3. Ароматичность гетероциклических систем. Критерии ароматичности.
4. Реакции электрофильного замещения в ароматических системах.
5. Химические свойства гидроксильной, карбоксильной и аминогрупп.
Содержание занятия:
1. Контроль выполнения домашнего задания.
2. Практическая часть «Гетерофункциональные соединения бензольного и гетероциклического ряда – родоначальники важнейших групп лекарственных и физиологически активных соединений».
2.1. Сочетание в бензольном ядре двух и трех гетерофункций (аминной, гидроксильной, карбоксильной, сульфогруппы) как химическая основа для получения разнообразных лекарственных средств на базе п‑аминофенола, п‑аминобензойной, салициловой, сульфаниловой, п‑аминосалициловой кислот.
2.2. Пятичленные гетероциклические соединения с одним атомом азота. Пиррол, бензопиррол и биологически активные вещества на их основе (порфириновые макроциклические соединения, триптофан и продукты его метаболизма).
2.3. Пятичленные гетероциклические соединения с двумя атомами азота (пиразол, имидазол). Пиразолон и лекарственные средства на его основе. Гистамин.
2.4. Шестичленные гетероциклические соединения с одним атомом азота. Пиридин, хинолин, лекарственные средства на их основе.
2.5. Строение и таутомерия барбитуровой кислоты. Барбитураты.
2.6. Пурин, его метилированные и гидроксипроизводные (мочевая кислота), их значение в биологических процессах. 6-Меркаптопурин как антиметаболит 6-аминопурина (аденина).
3. Лабораторная работа по теме.
4. Контроль выполнения лабораторной работы.
5. Контроль усвоения темы.
Неразрывная связь химии и медицины отчетливо проявляется в области создания и использования лекарственных средств. С давних времен эмпирическим путем происходил отбор биологически активных органических соединений, и появление ряда лекарственных средств часто было обязано случаю. В настоящее время ведется направленный синтез лекарственных препаратов с обязательным тестом на их биологическую активность (биологический скрининг). Проблема структура-свойство служит фундаментом целенаправленного синтеза новых эффективных лекарственных средств. Вместе с тем большое значение продолжают сохранять некоторые группы известных ранее препаратов, в частности таких, структурную основу которых составляет бензольное ядро.
Большое значение гетероциклических соединений объясняется тем, что к ним относятся природные вещества, ряд ценных лекарственных препаратов, красителей и т.д. Так, пиррольный и гидрированный пиррольный циклы как структурные единицы входят в состав важных биогенных соединений – аминокислот (пролин, триптофан), алкалоидов, гемоглобина, коферментов, хлорофилла и т.д. Пиридиновый цикл лежит в основе никотинамидов, входящих в состав необходимых для жизнедеятельности ферментов, витаминов группы РР, В6 и др. Пиримидиновые и пуриновые циклы входят в состав жизненно важных для организма нуклеиновых кислот, ответственных за синтез белка в клетке.
Своеобразие электронного строения производных бензола и гетероциклических соединений носит характерные черты, определяющие химические и фармакологические особенности лекарственных веществ на их основе.
Вопросы для самостоятельной работы
«Физиологически активные производные бензольного ряда»
1. Напишите реакции взаимодействия п-аминофенола с ангидридом уксусной кислоты, а полученного соединения с этиловым спиртом. Назовите продукты реакций и покажите, какое применение в медицине имеют производные п‑аминофенола.
2. Напишите реакцию получения бензоата натрия и покажите его медицинское применение.
3. Напишите реакции получения и гидролиза производных салициловой кислоты: салицилата натрия, метилсалицилата, фенилсалицилата (салола). Покажите медицинское применение этих препаратов и самой салициловой кислоты.
4. Напишите реакцию получения сложного эфира салициловой кислоты с уксусным ангидридом. Назовите продукт реакции и покажите его применение в медицине.
5. Напишите реакцию гидролиза аспирина, которая происходит при его хранении. Как можно проверить доброкачественность аспирина? (См. опыт 7).
6. Приведите строение п-аминосалициловой кислоты (ПАСК). Покажите ее применение в медицине и механизм действия.
7. Приведите строение п-аминобензойной кислоты (ПАБК) и покажите ее биологическую роль.
8. Напишите реакции взаимодействия ПАБК с этанолом и N,N-диэтиламиноэтанолом. Назовите продукты реакций, покажите медицинское применение и приведите строение их солянокислых солей, в виде которых препараты используются.
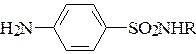
9. Приведите строение сульфаниламида и препаратов на его основе: сульфацила, норсульфазола, этазола, сульфапиридазина, сульфадиметоксина. Объясните антибактериальное действие сульфаниламидных средств и покажите факторы, влияющие на их антибактериальную активность.
10*. Объясните причину легкой растворимости в щелочах большинства сульфаниламидных лекарственных средств, имеющих общую формулу:
Лабораторная работа по теме
«Лекарственные вещества на основе бензола»
Опыт 1. Открытие белого стрептоцида и его производных
путем переведения его в азокраситель
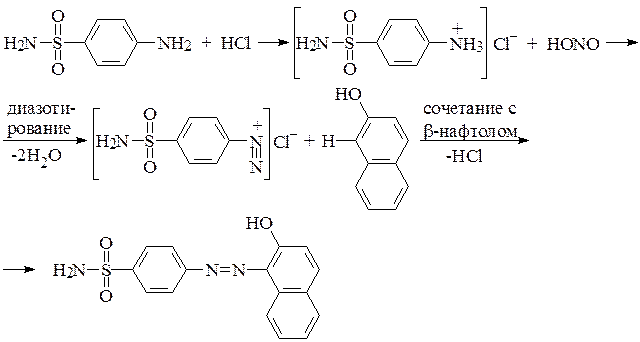
Функциональная группа -N=N- называется азогруппой, входит в азосоединения, например, в азокрасители.
Интенсивность окраски полученного красителя позволяет использовать эту реакцию для определения минимальных количеств его в моче, в крови, а также открывать производные белого стрептоцида – сульфаниламидные препараты, которые используются как противомикробные средства.
Методика
Небольшую крупинку белого стрептоцида поместить в пробирку и прибавить 3-4 капли 10% HCl для его растворения. Затем добавить 1-2 капли 5% NaNO2. В другую пробирку взять несколько крупинок b-нафтола и добавить 2-3 капли 10% NaOH. Прибавить сюда же 2-3 капли содержимого 1-ой пробирки. Немедленно образуется азокраситель интенсивного оранжево-красного цвета.
Приготовить сильно разбавленный раствор, разделить на 2 порции и убедиться, что в кислой среде краситель имеет желтую, а в щелочной – оранжево-красную окраску.
Аналогичный опыт можно повторить, взяв вместо стрептоцида сульфадимезин, сульфален, сульгин, фталазол, этазол, норсульфазол, альбуцид натрия и т.д.
Опыт 2. Получение фенолфталеина
Взаимодействие фенола и фталевого ангидрида приводит к образованию фенолфталеина.
|
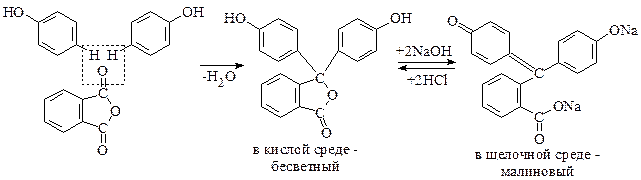
Фенолфталеин под названием пурген применяется как слабительное.
Методика
В сухую пробирку поместить несколько кристалликов фталевого ангидрида и 1 каплю жидкого фенола. Добавить 1 каплю концентрированной H2SO4 и осторожно нагреть на спиртовке до появления темно-красного окрашивания. После остывания смеси прибавить 8-10 капель воды.
Смочить 1-2 каплями этого раствора фильтровальную бумагу и в центр пятна поместить каплю 10% NaOH. Появляется малиновое окрашивание. При нанесении 1 капли 10% HCl происходит обесцвечивание. При подщелачивании обесцвеченный участок вновь становится малиновым.
Опыт 3. Возгонка и разложение салициловой кислоты
при нагревании
В сухую пробирку поместить несколько кристалликов салициловой кислоты и нагреть в пламени спиртовки.
Кислота плавится (t = 157°С) и возгоняется в виде белого налета, который быстро поднимается вверх по мере нагревания пробирки. Если нагреть быстро и так, чтобы пары кислоты проходили через нагретую зону, то наблюдается декарбоксилирование и образование фенола, что обнаруживается по характерному запаху. Написать уравнение этой реакции.
Опыт 4. Доказательство наличия фенольного гидроксила
в салициловой кислоте
В пробирку взять 2-3 кристаллика салициловой кислоты, прибавить 5-6 капель воды для ее растворения и 1 каплю FeCl3 (С(1/z) = 0,1 моль/л). Появляется темно-фиолетовое окрашивание, указывающее на наличие свободного фенольного гидроксила. Записать уравнение реакции между салициловой кислотой и FeCl3.
Опыт 5. Получение салицилово-этилового эфира
(этилсалицилата)
Поместить на дно сухой пробирки салициловую кислоту слоем 1 мм, прибавить 3 капли этилового спирта и 1 каплю концентрированной H2SO4. Очень осторожно нагреть пробирку на спиртовке, все время встряхивая ее, чтобы жидкость не выбросило. Постепенно образуется эфир в виде бурой жидкости с характерным запахом. Записать уравнение происшедшей реакции.
Этилсалицилат используют в смеси с жирными маслами для втирания при лечении ревматизма, а также для просветления анатомических препаратов.
Опыт 6. Доказательство наличия фенольного гидроксила
в салоле
Салол представляет собой фениловый эфир салициловой кислоты, в котором фенольный гидроксил остается свободным.
Вспомнить формулу салола и его применение.
Методика
Поместить в пробирку крупинку салола, прибавить для растворения 2 капли этилового спирта. К полученному раствору прибавить 1 каплю FeCl3. Появляется характерное красно-фиолетовое окрашивание.
Записать уравнение соответствующей реакции.
Прибавить в пробирку 2-3 капли воды. Жидкость мутнеет, окрашивание исчезает, так как салол плохо растворим в воде.
Опыт 7. Доказательство отсутствия фенольного гидроксила
в аспирине и гидролиз ацетилсалициловой кислоты
В две пробирки поместить по крупинке аспирина и по 2-3 капли воды, встряхнуть до полного растворения вещества. В одну пробирку добавить 1 каплю FeCl3. Обратить внимание на отсутствие фиолетовой окраски. Чем это объясняется?
Раствор во второй пробирке прокипятить около полминуты и затем прибавить 1 каплю FeCl3. Чем можно объяснить появление фиолетовой окраски?
Привести уравнение гидролиза ацетилсалициловой кислоты, как сложного эфира уксусной и салициловой кислот, и уравнение качественной реакции на освободившийся фенольный гидроксил.
Данная проба используется для определения чистоты аспирина, который при неправильном хранении (наличие влаги) разлагается.
Опыт 8. Взаимодействие бензойной и салициловой
кислот с бромной водой (Br2×aq)
В одну пробирку взять несколько кристалликов бензойной, а в другую – салициловой кислоты и по несколько капель воды для растворения кислот. В каждую пробирку прибавить по 2-3капли бромной воды, встряхнуть. Чем объяснить, что только салициловая кислота обесцвечивает бромную воду, почему она активнее бензойной в реакциях электрофильного замещения? При избытке Br2×aq происходит декарбоксилирование. Привести уравнения реакций, соответствующих схеме:
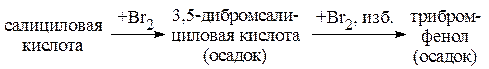
Вопросы для самостоятельной работы
«Физиологически активные производные
гетероциклического ряда»
1. Приведите строение пиррола и тетрапиррольного макроцикла порфина. Дайте определение понятия «порфирины», покажите их биологическую роль, приведите примеры.
2. Приведите строение индола (бензопиррола). В состав каких биологически активных соединений входит индол?
3. Напишите реакции, происходящие с триптофаном in vivo:
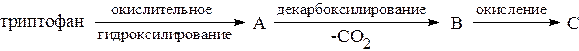
Назовите продукты реакции, покажите их биологическую активность.
4. Приведите реакцию декарбоксилирования триптофана (b-индолил-a-аминопропионовой кислоты). Назовите полученный биогенный амин, покажите его физиологическое действие.
5. Приведите строение имидазола. Объясните его ароматичность и амфотерность. В основе каких биологически активных соединений лежит имидазол?
6. Напишите реакцию декарбоксилирования гистидина. Назовите полученный биогенный амин, покажите его физиологическое действие.
7. Приведите строение пиразола, пиразолона-5 и анальгина. Каким действием обладают лекарственные препараты пиразолонового ряда?
8. Приведите строение пиридина. Объясните, почему это соединение является ароматическим. Напишите реакцию взаимодействия пиридина с соляной кислотой. Какие свойства проявляет пиридин в этой реакции?
9. Напишите реакцию получения никотиновой кислоты из b-метилпиридина (b-пиколина) и изоникотиновой – из g-метилпиридина (g-пиколина).
10. Приведите строение лекарственных соединений, включающих пиридиновый цикл: амида никотиновой кислоты – витамина РР; гидразида изоникотиновой кислоты – «Изониазида» («Тубазида») и продукта его конденсации с ванилином («Фтивазида»); 8-гидроксихинолина («Оксина»).
11. Приведите строение комплекса 8-гидроксихинолина с Ме2+. В основе какого процесса лежит образование этого соединения? Покажите строение и медицинское применение препарата 5-НОК (5-нитро-8-гидроксихинолина).
12. Приведите строение пиримидина, пурина. Укажите нумерацию атомов. Объясните, почему эти соединения являются ароматическими.
13. Напишите кето-енольные и лактим-лактамные формы барбитуровой кислоты (2,4,6-тригидроксипиримидина). Приведите строение 5,5-диэтилбарбитуровой кислоты («Барбитал») и 5-этил-5-фенилбарбитуровой кислоты («Фенобарбитал») и покажите медицинское применение барбитуратов.
14. Приведите строение ксантина (2,6-дигидроксипурина) в лактамной форме и его N-метилированных производных: теофиллина, теобромина и кофеина. К какой группе лекарственных препаратов их относят, какова их физиологическая активность?
15. Приведите строение мочевой кислоты (2,6,8-тригидроксипурина). Покажите образование моно- и динатриевой ее соли (см. опыт 8). К каким нарушениям в организме приводит образование нерастворимых солей мочевой кислоты?
16. Напишите строение противоопухолевых средств, производных пиримидина и пурина: 5-фторурацила и 6-меркаптопурина. Покажите принцип их действия.
17*. Поясните высокую устойчивость имидазола к действию даже сильных окислителей.
18*. Какой вид таутомерии обусловливает проявление кислотных свойств барбитуровой кислоты и отсутствует у барбитуратов? Поясните.
Лабораторная работа по теме
«Физиологически активные гетероциклические соединения»
Опыт 9. Растворимость мочевой кислоты
и ее натриевой соли в воде
Поместите в пробирку небольшое количество (на кончике лопаточки) мочевой кислоты. Прибавьте по каплям воду (5-8 капель), каждый раз встряхивая пробирку. Обратите внимание на плохую растворимость мочевой кислоты в воде. В холодной воде мочевая кислота почти нерастворима: 1 часть ее растворяется в 39000 частях воды.
После добавления 8 капель воды растворения все еще не заметно. Стоит, однако, добавить всего 1 каплю 10% раствора гидроксида натрия, как мутный раствор моментально просветляется вследствие образования относительно легкорастворимой двузамещенной соли натрия. Полученный раствор сохраните для последующего опыта.
Вопросы:
1. Напишите таутомерные формы мочевой кислоты.
2. Напишите схему взаимодействия мочевой кислоты с гидроксидом натрия.
Опыт 10. Открытие мочевой кислоты
(мурексидная проба)
На предметное стекло с помощью пипетки поместите 1 каплю раствора натриевой соли мочевой кислоты (см. опыт 9). Добавьте 1 каплю концентрированной азотной кислоты (на общем столе) и осторожно встряхивайте, держа стекло над пламенем спиртовки на некотором расстоянии (примерно 10 см). Как только раствор выпарится и начнется слабое покраснение пятна на месте бывшей капли, прекратите нагревание. Когда стекло остынет, сбоку от пятна поместите 1 каплю 10% раствора аммиака. На месте соприкосновения наблюдается появление полоски пурпурно-фиолетового цвета (мурексидная проба).
При окислении азотной кислотой мочевая кислота, как и прочие пуриновые основания, образуют аллоксантин. При смачивании образовавшегося аллоксантина аммиаком получается мурексид – аммониевая соль очень неустойчивой в свободном виде пурпурной кислоты. Мурексидная проба используется при анализе мочевых камней. Применяется эта проба также при открытии кофеина, теобромина и других пуриновых оснований.
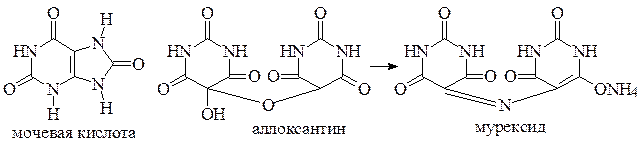
Вопросы:
1. Объясните причины возникновения окрашивания в мурексидной пробе.
2. Какое применение в медицине находит мурексидная проба?
– Конец работы –
Эта тема принадлежит разделу:
Рекомендуется в качестве пособия
БИООРГАНИЧЕСКАЯ ХИМИЯ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Лабораторно-практические занятия № 11, 12
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов