рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Рекомендуется в качестве пособия
Реферат Курсовая Конспект
Рекомендуется в качестве пособия
Рекомендуется в качестве пособия - раздел Образование, Государственное Бюджетное Образовательное Учреждение Высшего Профессиональног...
Государственное бюджетное образовательное учреждение высшего профессионального образования "Пермская государственная медицинская академия имени академика Е.А. Вагнера" министерства здравоохранения Российской Федерации
БИООРГАНИЧЕСКАЯ ХИМИЯ
Издание третье,
исправленное и дополненное
Рекомендуется в качестве пособия
к лабораторно-практическим занятиям
для студентов медицинских вузов
Пермь 2013
Государственное бюджетное образовательное учреждение
высшего профессионального образования "Пермская
государственная медицинская академия имени академика Е.А. Вагнера" Министерства здравоохранения Российской Федерации
УДК 577.1
ББК 24.2
Составители: К.Г. Галинова, Н.Ф. Гаврилова, Л.Ф. Гейн, И.Н. Глушкова, О.И. Иваненко, И.В. Крылова, И.А. Кожевникова, О.П. Тарасова.
Биоорганическая химия: учебное пособие для лабораторно-практических занятий – 3-ье изд., доп. и испр. / Сост. К.Г. Галинова и др.
- Пермь: ГБОУ ВПО ПГМА им. ак. Е.А. Вагнера Минздрава России, 2013. - 97с.
Пособие включает задачи с эталонами решения, вопросы и упражнения для самостоятельной работы, тестовые задания с ответами, вопросы к зачетам. Условия задач имеют медико-биологическую направленность. В пособие включены некоторые экспериментальные работы.
Учебное пособие соответствует учебной программе и ФГОС, предназначено для студентов лечебного, педиатрического, медико-профилактического и стоматологического факультетов ПГМА при подготовке к семинарским и практическим занятиям по химии, к сдаче зачета и экзамена.
Рецензенты:
Заведующий кафедрой физической и коллоидной химии Пермской государственной фармацевтической академии, доктор химических наук, профессор В.Л. Гейн
Заведующая кафедрой общей химии ФБГОУ ВПО Пермская ГСХА им. ак. Д.Н. Прянишникова, доктор химических наук, профессор Л.П. Юнникова
Печатается по решению центрального координационного методического совета ГБОУ ВПО ПГМА им. ак. Е.А. Вагнера Минздрава России 2013
Введение
Согласно учебному плану в течение одного семестра Вы прослушаете краткий лекционный курс биоорганической химии, которая изучает строение и реакционную способность органических веществ, лежащих в основе процессов жизнедеятельности, в непосредственной связи с познанием их биологической функции. Основными объектами биоорганической химии являются биополимеры (белки и пептиды, нуклеиновые кислоты, полисахариды), липиды, природные и синтетические биорегуляторы (витамины, гормоны, коферменты, лекарственные препараты).
Хотя биоорганическая химия как научное направление возникла на стыке ряда наук, базируется она, в основном, на материале органической химии, используя ее теоретические представления и весь богатый арсенал физико-химических методов исследования веществ. Поэтому изучение курса биоорганической химии начинается с раздела, посвященного теоретическим основам строения и реакционной способности органических соединений. На основе этих знаний будет рассмотрена химия основных биоорганических объектов.
Кроме курса лекций освоение материала осуществляется на лабораторно-практических занятиях. Типовое занятие включает в себя следующие компоненты: практическая работа, контроль выполнения лабораторной работы и контроль усвоения темы.
Цель практической части: закрепление и творческое развитие полученных в результате самоподготовки знаний о закономерностях в химическом поведении основных классов природных органических соединений.
На практической части занятия Вы обсуждаете наиболее важные вопросы курса, которые Вы найдете в данном пособии, и которые помогут Вам в организации самоподготовки.
Самоподготовка – основной путь приобретения знаний в высшей школе. Рекомендуем Вам следующий план самоподготовки к занятиям по биоорганической химии.
1. Посмотрев название темы очередного занятия, прежде всего определите, имеете ли Вы исходный уровень знаний, достаточный для изучения данной темы. Если это необходимо, изучите предыдущий материал. Можно заранее сказать, что при регулярной подготовке к каждому занятию, для Вас не будет неожиданных вопросов, так как исходный уровень постоянно формируется по восходящей линии от одного занятия к другому.
2. После этого изучите указанную тему по конспекту записанной Вами лекции и по учебнику Н.А. Тюкавкина, Ю.И. Бауков, С.Э. Зарубян «Биоорганическая химия», 2010.
3. Затем Вы сами можете определить степень готовности к занятию, ответив на вопросы для самостоятельной работы. Если при ответах Вы не встретите затруднений, можете считать себя достаточно подготовленным к занятию. В противном случае вновь вернитесь к информационному материалу.
Усвоение темы проверяется на каждом занятии 15-минутным контролем.
Цель лабораторной работы: на основе знания реакционной способности сформировать умения выполнять качественные реакции на функциональные группы и качественно определять некоторые органические соединения, встречающиеся в практике врача.
Для экономии аудиторного времени и осмысливания лабораторной работы Вы должны заранее частично заполнить протокол работы, который следует располагать на развернутом листе тетради:
| Номер занятия и название темы, дата | |||||
| № опытов | Название опыта | Схема реакции с указанием механизма | Условия реакции (t°, катализатор и т.д.) | Наблюдаемый результат опыта (изменение окраски, выделение газа, выпадение осадка и т.д.) | Выводы |
Графы 1, 2, 3, 4 заполняются заранее при подготовке к занятию, а графы 5 и 6 – после выполнения опытов. Особое внимание следует обратить на заполнение 6-ой графы. Правильный, хорошо продуманный и сформулированный вывод с элементами обобщения, сделанный на основе реакции, свидетельствует о сознательном и глубоком усвоении материала. В выводах желательно указать медицинское значение исходных и конечных продуктов реакций.
Полностью заполнив протокол, Вы показываете пробирки с опытами и защищаете работу, для чего Вам необходимо ответить на 1-2 вопроса к опытам по усмотрению преподавателя.
Выполнив указанное в плане количество лабораторно-практических работ по отдельным темам, Вы допускаетесь к контрольной работе. Содержание контрольных работ отражено в зачетных вопросах по темам.
Завершается курс биоорганической химии для студентов медико-профилактического факультета сдачей экзамена, объем и содержание его отражены в программе, которая Вам будет предложена на кафедре.
Биоорганическая химия для студентов лечебного, педиатрического и стоматологического факультетов заканчивается контрольными тестами по всему объему курса. В конце пособия прилагаются примерные варианты теста.
Правила по технике безопасности при работе в химической лаборатории
Прежде чем приступить к практической работе необходимо: - изучить имеющиеся в лаборатории инструкции по технике безопасности; - изучить правила по противопожарной безопасности и меры оказания первой помощи при несчастных случаях;Практическое занятие № 1
Тема: Электронное строение элементов-органогенов. Химическая связь в органических соединениях. Изомерия. Номенклатура.
Цель: Закрепить на основе школьного курса представления об электронном строении атома, гибридизации атомных орбиталей и химической связи как базовом материале для изучения биоорганической химии. Сформировать знания основных правил международной номенклатуры и умения использовать их в названиях органических соединений, являющихся объектом изучения биоорганической химии.
Исходный уровень: Из школьного курса необходимо знать:
1. Основные положения теории строения органических соединений А.М. Бутлерова. Изомерия (структурная; цис-транс-изомерия).
2. Электронное строение атома. Гибридизация атомных орбиталей (АО).
3. Ковалентная связь как основной вид связи в органических соединениях и ее параметры.
4. Основные правила международной номенклатуры ИЮПАК отдельных классов органических соединений – углеводородов, спиртов, альдегидов, карбоновых кислот, аминокислот.
Содержание занятия:
1. Практическая часть. Электронное строение атомов, химическая связь, изомерия, номенклатура.
1.1. Электронное строение элементов-органогенов.
1.2. Типы гибридизации АО.
1.3. Химическая связь и ее параметры: механизм образования, меры прочности, направленность (s- и p-связь), полярность, поляризуемость.
1.4. Принципы международной номенклатуры ИЮПАК.
1.5. Изомерия.
2. Контроль усвоения темы.
Учебный материал и обучающие задачи
К вопросу электронного строения атома
Электрон () имеет заряд –1 и обладает одновременно свойствами волны и частицы. С точки зрения квантовой механики нельзя дать строго координаты… Формы АО: s-АО p-АО d-АО гибридная АОГибридизация атомных орбиталей на примере углерода
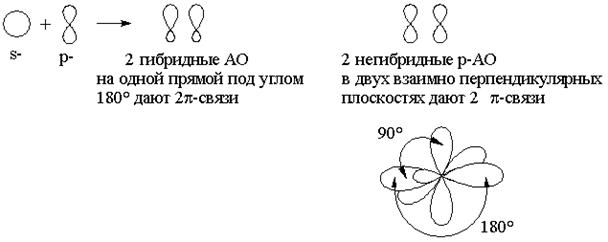
Гибридизация – процесс выравнивания АО по форме и энергии. Гибридизация возможна в тех случаях, когда число неспаренных электронов в основном состоянии атома меньше общего числа электронов на валентном уровне (C, Si, N, P, S, O, …).
 sp3-гибридизация:
sp3-гибридизация:
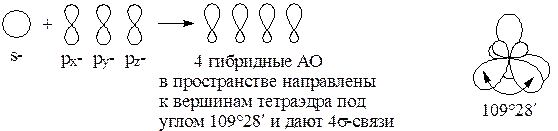
sp2-гибридизация:
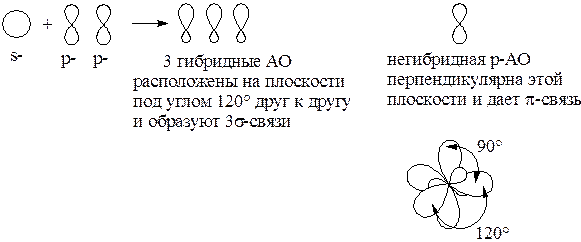
sp-гибридизация:
|
К вопросу химической связи
Ковалентная связь осуществляется образованием общих электронных пар между связываемыми атомами. Механизм образования ковалентной связи заключается в перекрывании АО…Тест № 1
2. Число орбиталей на р-подуровне равно 1) 1 2) 5 3) 7 4) 3Практическое занятие № 2
Тема: Взаимное влияние атомов в органических молекулах (сопряженные системы, сопряжение, ароматичность, электронные эффекты – индуктивный и мезомерный).
Цель: Сформировать знания об электронных эффектах и электронном строении молекул с сопряженными связями как о термодинамически устойчивых системах, используемых при построении биологически важных соединений.
Исходный уровень: Из школьного курса необходимо знать:
1. Виды гибридизации атома углерода и уметь изображать гибридизированные орбитали в пространстве.
2. Строение s- и p-связей.
Содержание занятия:
1. Контроль выполнения домашнего задания.
2. Практическая часть «Химические связи атома углерода и передача взаимного влияния атомов в органических молекулах».
2.1. s- и p-связи: электронное строение и основные характеристики (длина, энергия, поляризуемость).
2.2. Сопряженные системы. Энергия сопряжения. Ароматичность.
2.3. Электронные эффекты заместителей в алифатических и ароматических соединениях.
3. Контроль усвоения темы.
Тема «Электронное строение химических связей и взаимное влияние атомов в органических молекулах» – теоретический стержень курса. Такие важные понятия, как сопряжение, энергия сопряжения, ароматичность, электронные эффекты, электронодонорные и электроноакцепторные заместители, будут использоваться на протяжении всего курса. С их помощью качественно оценивается термодинамическая устойчивость и прогнозируется реакционная способность органических соединений, трактуются механизмы и сравниваются кислотно-основные свойства.
Вопросы для самостоятельной работы
«Взаимное влияние атомов в органических молекулах»
1. По взаимному расположению в молекуле двойных связей выберите из указанных соединений кумулированные, изолированные и сопряженные системы; назовите соединения.
а) СН2=СН-СН2-СН=СН2; б) СН3-СН=СН-СН=СН2;
в) СН2=С=СН-СН2-СН3; г)  ; д)
; д) 
Дайте определение сопряженным системам.
2. Дайте определение понятию «сопряжение» и выделите соединения (см. вопрос 1) с открытой и замкнутой цепью сопряжения.
3. Что такое энергия сопряжения? Сравните термодинамическую устойчивость молекул бутадиена-1,3 и циклогексатриена-1,3,5 (бензола).
4. В каком соединении есть сопряжение, укажите вид сопряжения (p,p- или р,p-), покажите графически.
а) СН2=СН-ОН б) 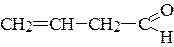 в) СН2=СН-СН2-ОН
в) СН2=СН-СН2-ОН
г) 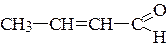 д) СН2=СН-Br е) СН2=СН-О-СН3
д) СН2=СН-Br е) СН2=СН-О-СН3
ж) 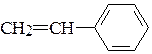 з)
з)  и)
и) 
к) 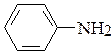
5. Являются ли ароматическими следующие соединения? Поясните.
а) 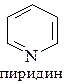 б)
б)  в)
в) 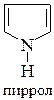 г)
г)  д)
д) 
е)  ж)
ж)  з)
з) 
Дайте понятие ароматичности. Объясните высокую термодинамическую устойчивость ароматических соединений на примере бензола.
6. Укажите в молекуле имидазола 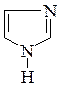 пиррольный и пиридиновый атомы азота и опишите их электронное строение.
пиррольный и пиридиновый атомы азота и опишите их электронное строение.
7. Дайте определение понятию «индуктивный эффект» и опишите, как он изображается графически. Изобразите его действие в молекулах:
а) CHCl3– хлороформа; б)  – пара-метилфенола;
– пара-метилфенола;
в) СН3-СООН – уксусной кислоты; г) Cl-CH2-COOH – монохлоруксусной кислоты.
8. Дайте определение понятию «мезомерный эффект» и покажите, как он изображается графически. Изобразите его действие в молекулах:
а) СН2=СН-СООН – акриловой кислоты; б) 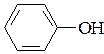 – фенола.
– фенола.
Покажите отличие мезомерного эффекта от индуктивного.
9. Что такое положительный и отрицательный мезомерный эффект? Изобразите действие этих эффектов в молекулах:
а) 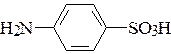 – сульфаниловой кислоты;
– сульфаниловой кислоты;
б) 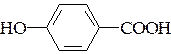 – пара-гидроксибензойной кислоты.
– пара-гидроксибензойной кислоты.
10. Укажите вид и знак электронных эффектов (обозначьте эффекты графически).
а) атома хлора в хлорбензоле  и хлористом бензиле
и хлористом бензиле 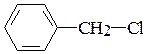 ;
;
б) карбоксильной группы в акриловой СН2=СН-СООН и пропионовой СН3-СН2-СООН кислотах;
в) заместителей в мета-крезоле 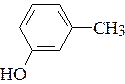 ;
;
г) заместителей в пара-аминобензойной кислоте 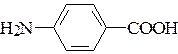 ;
;
д) альдегидной группы в бензальдегиде  и уксусном альдегиде
и уксусном альдегиде 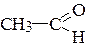 .
.
11. Что такое электронодонорные (ЭД) и электроноакцепторные (ЭА) заместители? Каким заместителем является
а) аминогруппа в молекулах этиламина C2H5-NH2 и анилина 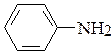 ;
;
б) гидроксигруппа в молекулах этанола C2H5-OH и фенола 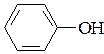 ;
;
в) атома хлора в хлористом виниле CH2=CH-Cl и хлорэтане C2H5-Cl.
12. Какие из ниже показанных заместителей могут быть: а) только ЭА; б) только ЭД; в) и ЭА и ЭД?
-COOH, -SO3H, -CH3, -OC2H5, -OH, -NO2, -NH2, -SH, Hal-, (CH3)2CH-, >C=O.
13. Сравните влияние гидроксильной группы на бензольное кольцо в феноле 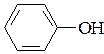 и бензиловом спирте
и бензиловом спирте 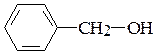 .
.

|
14*. В основе многих биологически важных соединений, таких как гемоглобин, витамин В12 и т.д., лежит порфиновый макроцикл. Объясните высокую термодинамическую устойчивость порфина к действию окислителей и ионизирующих излучений.
* Здесь и далее обозначены вопросы повышенной трудности.
Тест № 2
1) бензойная кислота 3) фенол 2) нитробензол 4) толуол 2.Положительный индуктивный эффект проявляет заместитель в соединенииЛабораторно-практическое занятие № 3
Тема: Реакционная способность углеводородов.
Цель: Сформировать умение прогнозировать способность основных групп углеводородов вступать в реакции гомолитического или гетеролитического взаимодействия во взаимосвязи с электронным строением атома углерода и электронными эффектами заместителей введенных в ядро.
Исходный уровень: Из школьного курса необходимо знать:
1. sp3-, sp2- и sp-гибридизация атома углерода.
2. Электронное строение s- и p-связей.
3. Сопряжение открытых и замкнутых систем. Ароматичность.
4. Электронные эффекты заместителей.
Содержание занятия:
1. Контроль выполнения домашнего задания.
2. Практическая часть «Зависимость химических свойств от электронного строения и типа химических связей атома углерода».
2.1. Радикальное замещение у насыщенного атома углерода (SR). Галогенирование алканов и окисление кислородом.
2.2. Реакции электрофильного присоединения (АЕ). Галогенирование, гидрогалогенирование, гидратация алкенов.
2.3. Реакции электрофильного замещения (SE). Галогенирование, сульфирование, нитрование, алкилирование ароматических углеводородов. Влияние заместителей в бензольном ядре на реакционную способность и их ориентирующее действие.
3. Контроль усвоения темы.
4. Лабораторная работа.
4.1. Свойства алканов.
4.2. Получение и свойства этилена.
4.3. Бромирование анилина.
5. Контроль выполнения лабораторной работы.
Углеводороды имеют ограниченное использование в медицине (вазелиновое масло, парафин, циклопропан). Детальное изучение их в курсе биоорганической химии обусловлено тем, что углеводороды лежат в основе всех классов биологически активных веществ.
Химические свойства углеводородов находятся в зависимости от состояния гибридизации атома углерода и степени делокализации p-связи. Для углеводородов, содержащих sp3-гибридизированный атом углерода (алканов), характерны реакции радикального замещения (SR); для углерода в sp2-гибридизации с локализованной p-связью (алкенов) и со слабо делокализованной p‑связью (диеновых) идут реакции электрофильного присоединения (АЕ); для аренов, все атомы цикла которых в sp2-гибридизации и p-связь сильно делокализована, в мягких условиях наиболее характерно электрофильное замещение (SE), реакции присоединения, ведущие к разрыву цикла, идут только в жестких условиях.
Вопросы для самостоятельной работы
«Реакционная способность углеводородов»
1. Классификация органических реакций по способу разрыва связей в субстрате и реагенте. Дать понятие радикала, электрофила, нуклеофила.
2. Покажите гомолиз и гетеролиз связи на примере молекул HBr, Br2, H2O, CH3I. Назовите образующиеся частицы.
3. Классификация органических реакций по конечному продукту с учетом реагента. Приведите примеры.
4. Поясните, почему для углерода в sp3-гибридизации (алканы и циклоалканы) характерны реакции замещения по радикальному механизму (SR).
5. Покажите пути образования радикалов.
6. Галогенирование насыщенных углеводородов при облучении лежит в основе получения их галогенопроизводных, применяемых в органическом синтезе и медицинской практике. Напишите реакцию и опишите по стадиям механизм:
а) хлорирования пропана;
б) бромирования этана;
в) хлорирования изобутана;
г) бромирования циклогексана.
7. Взаимодействие органических соединений с молекулярным кислородом – один из важнейших радикальных процессов. Покажите
а) in vitro окисление вторичных С-Н-связей наркозного эфира, приводящее к его порче;
б) in vivo схему пероксидного окисления липидного слоя клеточных мембран.
8. Поясните, почему для углерода в sp2-гибридизации (алкены и алкадиены) характерны реакции электрофильного присоединения (АЕ).
9. Напишите реакции галогенирования и опишите механизм АЕ
а) бромирования (хлорирования) этена;
б) бромирования пропена;
в) бромирования 2-метилпропена.
Сравните реакционную способность пропена и 2-метилпропена с этеном в реакциях электрофильного присоединения.
10. Напишите реакции гидрогалогенирования и опишите их механизм
а) этена с хлороводородом;
б) пропена с хлороводородом.
Сравните реакционную способность этена и пропена и дайте объяснение правилу Марковникова.
11. Напишите реакцию гидратации бутена-1 in vitro в условиях кислого катализа и опишите ее механизм. Сравните реакционную способность этена и бутена-1 и поясните правило Марковникова.
12. Гидратация непредельных соединений in vivo.
13. Объясните особенность присоединения галогеноводородов и воды к a,b-ненасыщенным кислотам.
14. На примере реакции бутадиена-1,3 с хлором покажите особенности реакций АЕ у диеновых углеводородов.
15. Поясните на примере бензола, почему для ароматических соединений, несмотря на их высокую ненасыщенность, характерны реакции замещения (SE).
16. Покажите образование электрофилов в реакциях SE: галогенирования, алкилирования, нитрования, сульфирования.
17. Из перечисленных ниже заместителей выберите ориентанты I и II рода, покажите их влияние на интенсивность реакций SE и ориентацию входящей группы: -NH2, -OH, -SO3H, -NO2, -OR, -COOH, -CH3, -Br, -CHO.
18. Напишите уравнение реакции бромирования бензойной кислоты. Опишите механизм и покажите ориентирующее действие СООН-группы. Что легче бромируется – бензойная кислота или бензол и почему?
19. Напишите уравнение реакции сульфирования гидроксибензола (фенола). Покажите механизм и ориентирующее действие ОН-группы. Что легче сульфируется – фенол или бензол и почему?
20. Напишите уравнение реакции алкилирования метилбензола (толуола). Покажите механизм и ориентирующее действие СН3-группы. Что легче алкилируется – толуол или бензол и почему?
21. Напишите уравнение реакции нитрования аминобензола (анилина). Покажите механизм и ориентирующее влияние NH2-группы. Что легче нитруется – анилин или бензол и почему?
22. Йодирование тирозина in vivo и алкилирование ароматических субстратов в биосинтезе жирорастворимых витаминов.
Лабораторная работа по теме
«Реакционная способность углеводородов»
Опыт 1. Свойства алканов.
На предметное стекло нанести на расстоянии друг от друга по 1 капле разбавленного раствора KMnO4 и бромной воды с каплей конц. H2SO4. Обе капли смешать с каплей вазелинового масла (смесь предельных углеводородов). Сделать вывод о реакционной способности алканов.
Опыт 2. Получение и свойства этилена.
В первую пробирку поместить 8 капель конц. серной кислоты, 4 капли этилового спирта и несколько крупинок оксида алюминия (Al2O3). Закройте пробирку пробкой с газоотводной трубкой и конец трубки опустите во вторую пробирку с 4 каплями бромной воды. Нагрейте первую пробирку над спиртовкой. Как только бромная вода обесцветится, опустите конец газоотводной трубки в заранее приготовленную третью пробирку с 1 каплей 2% раствора перманганата калия и 5 каплями воды. После обесцвечивания подожгите выделяющийся газ у конца газоотводной трубки.
Запишите реакции получения этилена и взаимодействия этилена с Br2 и KMnO4.
Опыт 3. Бромирование анилина.
В пробирку поместите 1 каплю анилина и 5-6 капель воды, хорошо перемешайте и прибавьте несколько капель бромной воды до появления белого осадка триброманилина. Реакция применяется в фармацевтическом анализе для открытия анилина и его производных.
Объясните активирующее и ориентирующее влияние аминогруппы в анилине и запишите уравнение реакции бромирования анилина.
Тест № 3
1) радикального замещения 2) электрофильного присоединения 3) нуклеофильного присоединения 4)… 2. Углеводород СН2=СН-СН3 преимущественно вступает в реакцииЛабораторно-практическое занятие № 4
Тема: Кислотность и основность по Бренстеду. Гидроксисоединения.
Цель: 1. Сформировать знания кислотности и основности органических соединений как важнейших свойств, определяющих большинство химических реакций в живых организмах.
2. Выработать умение прогнозировать реакционную способность спиртов в зависимости от их строения и строения реагентов.
Исходный уровень:
1. Электроотрицательность атомов по Полингу.
2. Электронные эффекты заместителей. ЭА и ЭД.
3. Электронное строение пиррольного и пиридинового атомов азота.
4. Классификация реакций по их механизму. Типы реагентов.
Содержание занятия:
1. Контроль выполнения домашнего задания.
2. Практическая часть «Кислотность и основность по Бренстеду. Гидроксисоединения».
2.1. Кислотность и основность по Бренстеду. Сравнительная характеристика кислотных свойств спиртов, тиолов, фенолов и карбоновых кислот.
2.2. Роль неподеленной пары электронов гетероатомов в проявлении основных свойств аминов, эфиров, тиоэфиров и спиртов.
2.3. Реакционная способность спиртов.
3. Лабораторная работа по теме «Гидроксисоединения».
4. Контроль выполнения лабораторной работы.
5. Контроль усвоения темы.
Важными аспектами реакционной способности органических соединений являются их кислотные и основные свойства. Перенос протона, например, между атомами кислорода, азота и серы наблюдается в ходе многих биохимических реакций. Большую роль в биохимических процессах также играет кислотный или основной катализ.
Для оценки кислотности и основности органических соединений часто используют теорию Бренстеда. Понятия «кислоты и основания Бренстеда» будут использоваться практически во всех последующих темах.
Вопросы для самостоятельной работы
«Кислотность и основность органических соединений»
1. Дайте определение кислоты и основания по Бренстеду (Б.).
2. Покажите протолитическую реакцию переноса Н+ от кислоты Б. к Н2О как основанию. Введите понятие сопряженной кислоты и сопряженного основания.
3. На примере HCl и HCN сравните силу кислоты Бренстеда и сопряженного ей основания.
4. Дайте определение кислотного центра (к.ц.) и покажите классификацию кислот Б. по кислотному центру.
5. Что такое Ка и рКа?
6. Поясните, почему по устойчивости аниона судят о силе кислоты.
7. Перечислите факторы, от которых зависит стабильность аниона (сила кислоты Б.).
8. Выделите кислотный центр в соединениях и составьте ряд возрастания кислотности. Объясните причину изменения кислотных свойств.
а) С2Н5-СН3; б) С2Н5-ОН; в) C2H5-NH2
9. Объясните и подтвердите реакциями различие в кислотных свойствах спиртов и тиолов:
рКа (С2Н5ОН) = 18,0; рКа (C2H5SH) = 10,5.
Покажите биороль тиолов и применение их в медицине.
10. Сравните кислотность предложенных соединений по рКа, укажите фактор, объясняющий изменение кислотности.
а) С2Н5ОН; б) 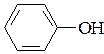 ; в)
; в) 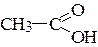
рКа = 18,0 рКа = 9,9 рКа = 4,7
Изобразите графически феноксид- и карбоксилат-ионы.
11. Покажите влияние заместителей (графически изобразите электронные эффекты) на кислотность соединений.
а) 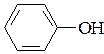 ; б)
; б) 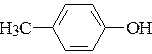 ; в)
; в) 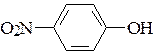
фенол п-метилфенол п-нитрофенол
рКа = 9,9 рКа = 10,1 рКа = 7,1
12. Объясните различие в кислотности этанола (рКа = 18,0) и этандиола-1,2
(рКа = 15). Подтвердите реакцией (опыт 2).
13. Покажите классификацию оснований Б. по основному центру (о.ц.) и дайте факторы, влияющие на силу основного центра.
14. Напишите протолитическую реакцию переноса протона от воды к основанию. Дайте понятие рКВН+.
15. Выделите основный центр в соединениях:
а)  ; б)
; б) 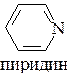 ; в)
; в) 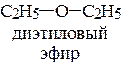 ; г)
; г) 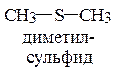 ;
;
д) 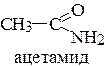
16. Объясните разницу в основности соединений. Отметьте электронные эффекты графически.
а) CH3-NH2; б) CH3-NH-CH3; в) 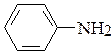 ; г)
; г) 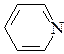
метиламин диметиламин анилин пиридин
рКВН+ = 10,6 рКВН+ = 10,8 рКВН+ = 4,58 рКВН+ = 5,23
17. Выделите кислотный и основный центры имидазола 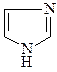 . Какими свойствами он обладает? Покажите возможность межмолекулярного взаимодействия за счет образования водородных связей.
. Какими свойствами он обладает? Покажите возможность межмолекулярного взаимодействия за счет образования водородных связей.
18*. Укажите кислотные центры и расположите их в порядке возрастания. Ответ поясните.
а)  – тирозин (a-аминокислота)
– тирозин (a-аминокислота)
б) – п-бензиламиносалициловая кислота
– п-бензиламиносалициловая кислота
(п-бензиламиносалициловая кислота в виде кальциевой соли – препарат бепаск – применяется для лечения туберкулеза)
19*. Объясните причину легкой растворимости сульфацила в щелочи. Покажите схему взаимодействия.
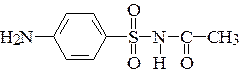 – сульфацил
– сульфацил
20*. Выделите основные центры, укажите место протонирования. Покажите биологическую роль этих соединений.
а) 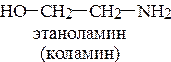 ; б)
; б) 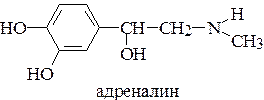
21*. Является ли холин аммониевым основанием? Поясните. Покажите биороль холина.
22*. Новокаинамид и анестезин применяются в медицине в виде водорастворимых гидрохлоридов. Напишите схему взаимодействия:
а) 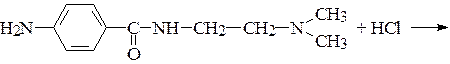
новокаинамид (при сердечной аритмии)
б) 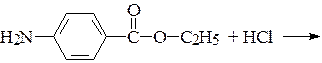
анестезин (для местной анестезии)
Тест № 4.1
2. Основание Бренстеда – это 1) донор электронов 3) акцептор электронов 2) донор протонов 4) акцептор протонов … 3. Кислотные свойства возрастают в ряду 1) OH, NH, CH кислоты … 4. Оба вещества реагируют с NaOH 1) этанол и фенол 3) этанол и этантиол 2) глицерин и…Вопросы к зачету по теме «Кислотность и основность органических соединений».
2. Дайте определение понятию «кислотный центр», перечислите кислотные центры, распределите их по силе. Сравните кислотность этанола, этантиола и… 3. Объясните, как изменяется кислотность фенольного гидроксила во взаимосвязи… 4. Расположите в ряд по увеличению кислотности следующие спирты: этанол, 2-хлорэтанол, 2,2-дихлорэтанол. Дайте…Реакционная способность гидроксисоединений
Углерод и водород, связанные с более электроотрицательным кислородом,…Тест № 4.2
2. Группа ОН проявляет в этаноле и феноле электронные эффекты 1) –I и –I 3) +М и–I,+М 2) –I и –I,+М 4) +I и +М … 3. Фенолы реагируют, а алифатические спирты не реагируют 1) с НCl 3) Cu(OH)2 2) NaOH …Вопросы кзачету по теме «Гидроксисоединения».
1. Одноатомные спирты. Представители: метанол, этанол, холестерин. Строение, действие на организм, применение в медицине, биороль. 2. Реакционная способность одноатомных спиртов на примере этанола: образование… 3. Многоатомные спирты. Представители: этиленгликоль, глицерин, инозит. Проявление кислотных свойств в сравнении с…Лабораторно-практическое занятие № 5
Тема: Оксопроизводные (альдегиды и кетоны).
Цель: Изучить основные свойства оксосоединений, имеющих значение для биологических процессов. Уметь проводить качественные реакции на отдельные представители альдегидов и кетонов.
Исходный уровень:
1. Строение двойной связи.
2. Электронные эффекты заместителей.
3. Нуклеофильные и электрофильные реагенты.
4. Кислотность и основность органических соединений.
5. Реакции элиминирования (дегидратация).
Содержание занятия:
1. Контроль выполнения домашнего задания.
2. Практическая часть «Биологически важные реакции карбонильных соединений».
2.1. Оксогруппа >С=О, ее электронное строение.
2.2. Реакции нуклеофильного присоединения (AN), механизм.
2.3. Реакции присоединения-отщепления.
2.4. Реакции альдольного присоединения и отщепления.
2.5. Реакции диспропорционирования.
2.6. Качественные реакции.
3. Лабораторная работа по теме «Оксосоединения».
4. Контроль выполнения лабораторной работы.
5. Контроль усвоения темы.
Альдегиды и кетоны широко используются в медицине и промышленности. Формальдегид применяется в анатомической и гистологической практике, в производстве лекарственных средств (уротропин), пластмасс (фенолформальдегидные смолы). Уксусный альдегид применяется в производстве уксусной кислоты, этилацетата.
Хлоральгидрат – лекарственное средство седативного действия. Цитраль применяется в глазной практике. Карбонильная группа >C=O встречается во многих биологически важных соединениях.
Реакционная способность карбонильной группы связана с ее электронным строением:
альдегид кетон
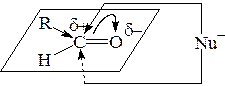

Реакционный центр – атом углерода карбонильной группы находится в состоянии sp2-гибридизации и образует три s-связи, лежащие в одной плоскости под углом 120°, и p-связь за счет негибридизированной p-АО. Вследствие различия в электроотрицательности атомов углерода и кислорода p-связь >C=O сильно поляризована. В результате на атоме углерода карбонильной группы возникает эффективный положительный заряд d+, а на атоме кислорода – отрицательный заряд d-. Поскольку атом углерода электронно-дефицитен, то подвергается нуклеофильной атаке, которая заканчивается гетеролизом p-связи и образованием продуктов нуклеофильного присоединения (AN). Атака нуклеофилом может осуществляться как сверху, так и снизу плоскости.
Кетоны обладают меньшей реакционной способностью, так как электронные эффекты углеводородных радикалов уменьшают частичный положительный заряд на карбонильном атоме углерода и создают пространственные затруднения для нуклеофильной атаки.
В кислой среде активность карбонильной группы увеличивается, поскольку вследствие протонирования атома кислорода (центр электрофильной атаки) на атоме углерода возникает полный положительный заряд:
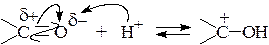
Кислотный катализ используют в тех случаях, когда атакующий нуклеофил обладает низкой активностью.
Вопросы для самостоятельной работы
«Оксосоединения»
1. Напишите уравнение реакции гидратации формальдегида, ацетальдегида и трихлоруксусного альдегида (хлораля). Какие из них дают устойчивые гидратные формы и почему? Каково медицинское значение хлоральгидрата?
2. Напишите уравнение реакции взаимодействия пропаналя с метиловым, этиловым или пропиловым спиртом. Опишите механизм, учитывая роль кислотного катализа и обратимость реакции.
3. Напишите уравнение реакции взаимодействия: а) ацетона; б) бензальдегида – с синильной кислотой (HCN) в щелочной среде.
4. Напишите уравнение реакции этаналя с: а) метиламином; б) аминобензолом (анилином). Укажите механизм реакции.
5. Напишите уравнение реакции получения гексаметилентетрамина (уротропина) и покажите его медицинское значение.
6. Напишите уравнение реакции альдольной конденсации ацетальдегида и пропаналя. Опишите механизм реакции. Будут ли вступать в эту реакцию триметилуксусный альдегид и бензальдегид? Какая структурная особенность альдегидов учитывается в этой реакции? Объясните причину появления CH-кислотного центра у альдегидов в реакции альдольной конденсации.
7. Напишите уравнение реакции диспропорционирования (реакция Канниццаро): а) формальдегида; б) бензальдегида. Какая особенность в строении предопределяет участие альдегида в этой реакции?
8. Напишите уравнение реакции восстановления: а) формальдегида; б) ацетальдегида; в) ацетона. Какое действие оказывают на организм эти вещества?
9. Напишите уравнение реакции окисления:
а) формальдегида оксидом серебра в водном растворе аммиака (реакция «серебряного зеркала»);
б) ацетальдегида гидроксидом меди (II).
Какие изменения в окраске происходят в ходе этих реакций? Будет ли в этих условиях окисляться ацетон?
10. Для открытия ацетона в моче больных сахарным диабетом используют йодоформную реакцию. Какие из соединений: диэтилкетон, метилэтилкетон, этанол, этаналь – также будут давать йодоформную пробу? Напишите химизм данной реакции.
Лабораторная работа по теме
«Оксосоединения»
Опыт 1. Диспропорционирование формальдегида
в водных растворах
Поместите в пробирку 2-3 капли 40% формалина. Добавьте 1 каплю 0,2% раствора индикатора метилового красного. Покраснение раствора указывает на кислую реакцию среды.
Вопросы:
1. Напишите реакцию диспропорционирования формальдегида. Наличие какого соединения обусловливает кислую реакцию среды?
Опыт 2. Окисление формальдегида и ацетона в щелочной среде
Окисление оксидом серебра (реакция серебряного зеркала).
Возьмите две пробирки и в каждую из них поместите по 1 капле 5% раствора нитрата серебра AgNO3 и 10% раствора гидроксида натрия NaOH. К полученному бурому осадку добавьте по каплям 10% водный раствор аммиака до полного его растворения. Затем в 1-ую пробирку прибавьте 2 капли 40% формалина, а во 2-ую – 2 капли ацетона. В 1-ой пробирке образуется осадок черного цвета, который при осторожном нагревании может выделиться на стенках пробирки в виде блестящего зеркального налета. Эта реакция носит название реакции «серебряного зеркала». Во 2-ой пробирке выпадение осадка не наблюдается.
Вопросы:
1. Напишите уравнение реакции «серебряного зеркала». Чем объясняется выпадение осадка черного цвета в 1-ой пробирке?
2. Что произойдет с продуктами реакции при дальнейшем окислении, то есть при избытке окислителя? Напишите уравнение реакции.
3. Объясните, почему во 2-ой пробирке не наблюдается выпадения осадка?
Окисление гидроксидом меди (реакция медного зеркала).
Поместите в каждую из двух пробирок по 5 капель 10% раствора гидроксида натрия и воды, добавьте по 1 капле 2% раствора сульфата меди CuSO4. К выпавшему осадку гидроксида меди (II) прибавьте в 1-ую пробирку 3 капли 40% раствора формалина, а во 2-ую – 3 капли ацетона. В 1-ой пробирке осадок приобретает сначала желтый цвет, затем – красный и, если пробирка чистая, на ее стенках может выделиться металлическая медь («медное зеркало).
Изменение окраски осадков объясняется различной степенью окисления меди.

голубая желтая красная металлическая
окраска окраска окраска медь
Вопросы:
1. Наблюдается ли выпадение осадка во 2-ой пробирке?
2. Напишите реакцию окисления формальдегида гидроксидом меди (II).
3. Сравните способность к окислению формальдегида и ацетона на основании экспериментальных наблюдений.
Опыт 3. Открытие ацетона переводом его в йодоформ.
(используется для диагностики сахарного диабета)
В пробирку поместите 1 каплю раствора йода в иодиде калия и прибавьте почти до обесцвечивания по каплям 10% раствора гидроксида натрия. К обесцвеченному раствору добавьте 1 каплю ацетона. При слабом нагревании от тепла рук выпадает желто-белый осадок с характерным запахом йодоформа.
Вопросы:
1. Напишите реакцию образования йодоформа.
2. Способен ли этиловый спирт образовывать йодоформ?
3. Какие соединения можно обнаружить с помощью йодоформной пробы? Какие структурные фрагменты они должны содержать?
Тест № 5
2. При взаимодействии ацетилена (С2Н2) с водой в присутствии HgSO4…Вопросы к зачету по теме «Оксосоединения».
1. Альдегиды и кетоны. Реакции нуклеофильного присоединения воды, спиртов, первичных аминов и их производных. Влияние электронных и пространственных… 2. Напишите уравнение реакции гидратации трихлоруксусного альдегида (хлораля).… 3. Напишите уравнение реакции этаналя с метанолом. Опишите механизм с использованием кислотного катализа на стадии…Лабораторно-практическое занятие № 6
Тема: Карбоновые кислоты и их функциональные производные. Липиды.
Цель: Закрепить знания закономерностей и особенностей в химическом поведении карбоновых кислот и их функциональных производных, лежащих в основе важнейших биологических процессов; сформировать знания о строении и свойствах омыляемых липидов – структурных компонентов клеточных мембран; уметь проводить некоторые характерные и качественные реакции на кислоты.
Исходный уровень:
1. Электронное строение атома углерода (sp3-, sp2-гибридизация).
2. Цис-транс-изомерия.
3. Электронные эффекты заместителей.
4. Кислотность и основность. Водородные связи.
5. Механизм реакций электрофильного присоединения (АЕ) и нуклеофильного замещения (SN).
Содержание занятия:
1. Контроль выполнения домашнего задания.
2. Практическая часть «Реакционная способность карбоновых кислот и их производных. Строение и свойства липидов».
2.1. Электронное строение карбоксилат-иона.
2.2. Функциональные производные карбоновых кислот – сложные эфиры, амиды и их гидролиз. Механизм реакции нуклеофильного замещения (SN).
2.3. Нейтральные липиды (триацилглицерины – ТАГ). Строение и стереоизомерия ненасыщенных высших жирных кислот.
2.4. Фосфолипиды. Фосфатидилколамины (кефалины) и фосфатидилхолины (лецитины) – структурные компоненты клеточных мембран.
2.5. Угольная кислота и ее производные.
3. Лабораторная работа по теме «Карбоновые кислоты».
4. Контроль выполнения лабораторной работы.
5. Контроль усвоения темы.
Карбоновые кислоты и их функциональные производные необходимы для изучения многих последующих разделов биоорганической химии и таких дисциплин, как биохимия и фармакология.
Хлорангидриды и ангидриды кислот – ацилирующие агенты в химии белка; амиды – белки; сложные эфиры – липиды, выполняющие в организме двоякую биологическую роль – источника энергии и составной части клетки. Фосфолипиды участвуют в построении клеточных мембран.
Реакционная способность карбоновых кислот определяется электронным строением карбоксильной группы, которая одновременно содержит карбонильную и гидроксильную группы. p-Электроны OH-группы сопрягаются с p-электронами кратной связи группы >C=O (p,p-сопряжение). Это приводит к равномерному распределению электронной плотности между обоими атомами кислорода в карбоксильной группе и оказывает определяющее влияние на активность реакционных центров в ней.
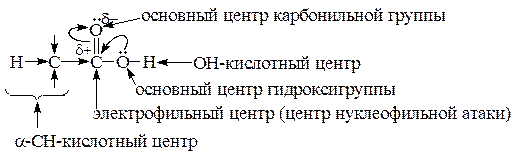
Вследствие p,p-сопряжения в карбоксильной группе:
1) уменьшается d+ на атоме углерода по сравнению с оксосоединениями, и для кислот не характерны реакции нуклеофильного присоединения, а только нуклеофильного замещения (SN), причем OH-группа легче уходящая, чем в спиртах;
2) усиливается основность оксониевого центра карбонильной группы (взаимодействие с H+-катализатором в реакциях SN);
3) увеличивается активность OH-кислотного центра по сравнению со спиртами (pKa(C2H5OH) = 18, а pKa(CH3COOH) = 5), и карбоновые кислоты взаимодействуют уже с оксидами, гидроксидами и солями активных металлов;
4) понижается активность основного центра гидроксигруппы в сравнении со спиртами.
Группа -СООН является сильным электроноакцептором (-I и –M), что приводит к усилению a-CH-кислотного центра и a-водородные атомы способны замещаться по радикальному механизму.
Вопросы для самостоятельной работы
«Карбоновые кислоты и липиды»
1. Напишите схему диссоциации уксусной кислоты. Приведите электронное строение карбоксилат-аниона и поясните более высокую активность OH-кислотного центра карбоновых кислот по сравнению со спиртами.
2. Расположите кислоты в ряд по увеличению кислотности:
а) муравьиную, хлоруксусную, фторуксусную, пропионовую, b-хлорпропионовую;
б) н-масляную, уксусную, хлоруксусную, щавелевую.
Результат поясните.
3. Напишите уравнения реакций солеобразования с гидроксидом кальция уксусной, щавелевой, пальмитиновой кислот.
4. Опишите механизм реакции этерификации:
а) уксусной кислоты и пропанола-2;
б) масляной кислоты и метилового спирта;
в) валериановой кислоты и этилового спирта;
Объясните необходимость кислотного катализа.
5. Напишите уравнение реакции получения полного и неполного амида малоновой кислоты. По какому механизму протекает эта реакция?
6. Покажите реакции образования ангидрида янтарной и уксусной кислот.
7. Напишите уравнение реакции декарбоксилирования:
а) щавелевой кислоты;
б) янтарной кислоты.
Объясните возможность протекания этой реакции.
8. Получите натриевую соль стеариновой кислоты из жира. Какое практическое применение имеют соли высших жирных кислот?
9. Напишите уравнение реакции гидрогенизации триацилглицерина, в состав которого входят олеиновая, линолевая и стеариновая кислоты.
10. Напишите схему взаимодействия пальмитоолеофосфатидной кислоты с коламином. К каким биологически активным соединениям относится конечный продукт? Его биороль.
11. Приведите структурную формулу фосфатидилхолина, в состав которого входят стеариновая и олеиновая кислоты, а также реакцию его кислотного гидролиза.
12. Напишите уравнение реакции образования и щелочного гидролиза кефалина, содержащего пальмитиновую и линолевую кислоты.
13. Напишите схему повреждения клеточных мембран при воздействии ионизирующего излучения.
14. Напишите уравнения реакций образования моно- и диамида угольной кислоты и биологически активные вещества на их основе: карбамоилфосфат, мепробамат, бромизовал. Укажите их биологическую активность.
15. Иминомочевина (гуанидин) и биологически активные вещества на ее основе: аргинин, гуанин и креатинфосфат, их биологическая роль.
Лабораторная работа по теме
«Карбоновые кислоты и их производные»
Опыт 1. Открытие уксусной кислоты
В пробирку поместите по 3 капли уксусной кислоты и воды. Испытайте реакцию раствора на лакмус. К раствору прибавьте 2-3 капли 10% раствора гидроксида натрия до полной нейтрализации уксусной кислоты. После этого добавьте 2-3 капли 1% раствора хлорида железа FeCl3. Появляется желто-красное окрашивание ацетата железа (III).
Нагрейте раствор до кипения. Выделяется красно-бурый осадок нерастворимого в воде гидроксида диацетата железа. Раствор над осадком становится бесцветным.
Вопросы:
1. Напишите схему диссоциации уксусной кислоты. Как подтверждается этот процесс экспериментально?
2. Напишите схему реакции уксусной кислоты с гидроксидом натрия. Как можно определить экспериментально нейтрализацию уксусной кислоты?
3. Напишите схему реакции образования ацетата железа (III).
4. Напишите структурную формулу гидроксида диацетата железа.
Опыт 2. Образование нерастворимых кальциевых солей
высших жирных кислот
В пробирку поместите 5 капель раствора мыла и добавьте 1 каплю раствора хлорида кальция CaCl2. Взболтайте содержимое пробирки. Появляется белый осадок.
Вопросы:
1. Напишите схему реакции образования кальциевой соли стеариновой кислоты.
2. Какие соединения называются мылами?
Опыт 3. Открытие щавелевой кислоты в виде кальциевой соли
В пробирку поместите лопаточку щавелевой кислоты и прибавьте 4-5 капель воды до полного растворения. Затем добавьте 1 каплю раствора хлорида кальция. Выпадает кристаллический осадок.
Вопросы:
1. Напишите схему реакции образования оксалата кальция.
Опыт 4. Получение этилацетата
В сухую пробирку поместите порошок безводного ацетата натрия (высота около 2 мм) и 3 капли этилового спирта. Добавьте 2 капли концентрированной серной кислоты и осторожно нагрейте над пламенем горелки (раствор может выплеснуться!). Через несколько секунд появляется приятный запах этилацетата.
Реакция используется для открытия этилового спирта.
Вопросы:
1. Напишите схему реакции образования этилацетата.
2. По какому механизму она осуществляется?
3. Какова роль концентрированной серной кислоты в реакции?
Тест № 6
1) простой эфир 3) ангидрид 2) сложный эфир 4) амид 2. Продукт взаимодействия муравьиной кислоты и метилового спирта 1) соль уксусной кислоты 2) диамид щавелевой кислоты 3) ангидрид малоновой…Вопросы к зачету «Карбоновые кислоты и липиды».
1. Напишите схему диссоциации уксусной кислоты. Приведите электронное строение карбоксилат-иона. Поясните более высокую активность ОН- группы… 2. Расположите в ряд по увеличению кислотности следующие соединения:… 3. Напишите уравнения реакций солеобразования и получения сложного эфира муравьиной кислоты.Лабораторно-практическое занятие № 7
Тема: Основные положения стереоизомерии. Реакционная способность гидрокси- и оксокислот как гетерофункциональных соединений.
Цель: Сформировать знания стереохимии и реакционной способности гидрокси- и оксокислот как гетерофункциональных соединений, составляющих основу биохимических процессов.
Исходный уровень:
1. Кислотные и основные свойства органических соединений.
2. Электронные эффекты.
3. Химические свойства гидроксильной, карбонильной и карбоксильной групп.
4. Механизм реакций нуклеофильного присоединения и замещения. Реакции элиминирования (дегидратации).
Содержание занятия:
1 Контроль выполнения домашнего задания.
2. Практическая часть «Реакционная способность гидрокси- и оксокислот. Стереоизомерия».
2.1. Энантиомерия. Диастереоизомерия. Оптическая активность. Рацематы.
2.2. a,b,g-Гидроксикислоты. Химические свойства по функциональным группам, специфические свойства (реакции циклизации, декарбоксилирования, дегидратации).
2.3. Важнейшие гидроксокислоты – участники обменных процессов. Строение и химические свойства. Кето-енольная таутомерия.
3. Лабораторная работа по теме «Гидрокси- и оксокислоты».
4. Контроль выполнения лабораторной работы.
5. Контроль усвоения темы.
Стереохимия изучает пространственное строение органических соединений. Ее можно назвать химией соединений в трехмерном пространстве. Пространственное строение взаимосвязано не только с физическими и химическими свойствами веществ, но и проявляемой ими биологической активностью. Установление взаимосвязи структуры соединения с механизмом его биологического функционирования является фундаментальной проблемой биоорганической химии и особенно важно для биологии и медицины.
Вопросы для самостоятельной работы
«Стереоизомерия»
1. Дайте определение стереоизомеров и назовите виды стереоизомерии.
2. Какая из молекул является хиральной: а) пропановой кислоты; б) молочной кислоты? Дайте определение хирального центра и назовите условия асимметричности молекулы.
3. Напишите проекционные формулы D- и L-молочной кислоты и стандарта, по которому определяется ее принадлежность к стереохимическому ряду.
4. Дайте определение энантиомеров. Напишите проекционные формулы энантиомеров яблочной кислоты. Отметьте асимметрический атом углерода и укажите принадлежность к D- и L-стереохимическим рядам.
5. Дайте определение диастереомеров, покажите их отличие от энантиомеров. Напишите проекционные формулы:
а) L-винной кислоты и ее диастереомера;
б) D-винной кислоты и ее диастереомера.
6. Что такое рацемат и обладает ли он оптической активностью? Напишите проекционные формулы стереоизомеров винной кислоты, образующих рацемат – виноградную кислоту.
7. Напишите строение мезовинной кислоты. Отметьте асимметрические атомы углерода. Укажите причину отсутствия оптической активности у мезовинной кислоты.
8. Покажите на примере связь биологической активности и пространственного строения вещества.
9. Дайте определение p-диастереомеров, покажите их отличие от оптических изомеров. Напишите формулы цис- и транс-бутендиовой кислоты. Дайте тривиальное название изомеров и покажите их физиологическое действие.
Подавляющее большинство веществ, участвующих в метаболизме, принадлежит к поли- или гетерофункциональным соединениям. Реакционная способность их определяется свойствами соответствующих монофункциональных производных. Однако наличие нескольких функциональных групп в молекуле ведет к появлению определенных различий в свойствах: 1) усиление или ослабление каких-то свойств, характерных для монофункциональных соединений;
2) появление специфических свойств, которые наиболее важны для обеспечения биологических функций, выполняемых этими веществами.
Вопросы для самостоятельной работы
«Реакционная способность гидрокси- и оксокислот»
1. Напишите реакции молочной кислоты: а) с гидроксидом натрия; б) этанолом; в) уксусной кислотой. Укажите принадлежность к классу и дайте названия продуктов реакций.
2. Напишите реакцию окисления молочной кислоты в процессе метаболизма.
3. Напишите специфические реакции, протекающие при нагревании: а) молочной кислоты; б) g-гидроксимасляной кислоты (ГОМК). К какому классу соединений относятся лактиды и лактоны? Покажите действие и применение ГОМК.
4. Дайте понятие кето-енольной таутомерии и напишите таутомерные формы: а) ацетоуксусной кислоты; б) щавелевоуксусной кислоты.
5. Напишите реакции восстановления и декарбоксилирования b-кетомасляной кислоты, приводящие к образованию «кетоновых тел».
6. Что такое «кетоновые тела». Покажите химизм их образования. При каких нарушениях в организме проводится их определение в биологических жидкостях (моче, крови)?
7. Покажите схему биосинтеза лимонной кислоты в цикле трикарбоновых кислот (фрагмент цикла Кребса).
8*. Напишите реакцию дегидратации b-гидроксимасляной кислоты. Объясните подвижность водородных атомов a-CH-кислотного центра. Назовите продукт реакции.
Лабораторная работа по теме
«Гидрокси- и оксокислоты»
Опыт 1. Доказательство наличия двух карбоксильных групп
в винной кислоте
В пробирку поместите 1 каплю 15% раствора винной кислоты, 2 капли 5% раствора KOH и встряхните. Постепенно выделяется малорастворимый белый кристаллический осадок в виде кислой калиевой соли винной кислоты (гидротартрат калия). Для ускорения выпадения осадка пробирку можно охладить под струей воды. Добавьте в пробирку еще 4-5 капель раствора KOH. Кристаллический осадок постепенно растворяется, так как образуется хорошо растворимая в воде средняя калиевая соль винной кислоты (тартрат калия). Раствор тартрата калия сохраните для следующего опыта.
Вопросы:
1. Напишите реакции образования гидротартрата и тартрата калия.
2. О чем свидетельствует образование двух солей винной кислоты?
Опыт 2. Доказательство наличия гидроксильных групп
в винной кислоте
В две пробирки поместите по 2 капли 2% раствора сульфата меди (II) и 10% раствора NaOH. Выпадает голубой осадок гидроксида меди (II). В 1-ую пробирку добавьте раствор тартрата калия, полученный в предыдущем опыте. Осадок гидроксида меди (II) растворяется с образованием синего раствора. Жидкости в обеих пробирках нагрейте до кипения. В первой пробирке цвет жидкости не изменяется, во второй – голубой осадок гидроксида меди (II) превращается в оксид меди (II) черного цвета. Образовавшийся синий раствор называется реактив Фелинга и применяется для обнаружения глюкозы в моче.
Вопросы:
1. Напишите схему взаимодействия гидроксида меди (II) с тартратом калия. Наличием какого структурного фрагмента обусловлена реакция?
2. Объясните, почему не изменяется цвет в первой и изменяется во второй пробирке.
Опыт 3. Разложение лимонной кислоты
В сухую пробирку, снабженную газоотводной трубкой, поместите лопаточку лимонной кислоты и 10 капель конц. серной кислоты, нагрейте. Конец газоотводной трубки опустите в 1-ую пробирку с 5 каплями раствора гидроксида кальция. После того, как раствор помутнеет, перенесите газоотводную трубку во 2-ую пробирку, содержащую две капли раствора йода в йодиде калия, предварительно обесцвеченного 10% р-ром NaOH. Выпадает желтый осадок.
Вопросы:
1. Какой продукт разложения лимонной кислоты обнаруживается в 1-ой пробирке? Напишите схему реакции.
2. Какой продукт разложения лимонной кислоты обнаруживается в 2-ой пробирке? Напишите схему реакции.
Тест № 7
2. Условиями хиральности молекулы являются 1) наличие одного или…Лабораторно-практическое занятие № 8
Тема: Аминокислоты и белки.
Цель: Сформировать знания строения и свойств важнейших a-аминокислот и химических основ структурной организации белковых молекул для дальнейшего изучения биологических функций белков.
Исходный уровень:
5) Кислотность и основность органических соединений.
6) Водородная связь.
7) Реакции нуклеофильного замещения в карбоксильной группе. Получение амидов кислот и их гидролиз.
8) Химические свойства аминогруппы. Основность и нуклеофильность аминогруппы.
9) Окисление тиолов и восстановление дисульфидов.
Содержание занятия:
1. Контроль выполнения домашнего задания.
2. Практическая часть «Аминокислоты и белки».
2.1. Стереоизомерия аминокислот.
2.2. Кислотно-основные свойства a-аминокислот.
2.3. Свойства a-аминокислот по COOH-группе (образование эфиров, амидов, декарбоксилирование).
2.4. Свойства по NH2-группе (образование оснований Шиффа, дезаминирование окислительное и неокислительное).
2.5. Специфические свойства a-аминокислот, связанные с химической модификацией радикала (гидроксилирование, обратимое окисление тиогрупп, карбоксилирование).
3. Лабораторная работа по теме «Аминокислоты и белки».
4. Контроль выполнения лабораторной работы.
5. Контроль усвоения темы.
a-Аминокислоты занимают ключевое положение в азотистом обмене. Они являются простейшими кирпичиками в структуре белков – важнейших соединений организма. Многие из a-аминокислот используются в медицинской практике в качестве лекарственных средств, влияющих на тканевый обмен.
С химической точки зрения a-аминокислоты как гетерофункциональные соединения вступают в реакции, характерные для карбоксильной группы и аминогруппы, а также обладают свойствами, обусловленными взаимным влиянием этих функций. Некоторые химические свойства a-аминокислот связаны с наличием функциональных групп в радикале.
Вопросы для самостоятельной работы
«Аминокислоты и белки»
1. Дайте общую формулу a-аминокислот, покажите их медико-биологическое значение, перечислите незаменимые a-аминокислоты.
2. Дайте классификацию a-аминокислот:
а) по химической природе радикала;
б) по полярности бокового радикала;
в) по числу групп -COOH и -NH2 в молекуле.
Приведите примеры.
3. Покажите стереоизомерию a-аминокислот на примере a-аминопропионовой кислоты (аланина). Выделите центр хиральности, укажите стандарт, по которому определяют принадлежность к D- и L-ряду. Аминокислоты какого ряда принимают участие в биосинтезе белка?
4. Дайте определение понятия «диполярный ион» или «внутренняя соль». Напишите строение внутренней соли гистидина и поясните возможность ее образования.
5. Что такое изоэлектрическое состояние и изоэлектрическая точка a-аминокислоты и белка? Покажите, в какой форме, анионной или катионной, находится в организме при физиологических значениях рН:
а) глутаминовая кислота (рI = 3,22);
б) аланин (рI = 6,0);
в) лизин (рI = 9,7).
6. Напишите реакции взаимодействия аланина с гидроксидом натрия и соляной кислотой. Поясните, какое свойство проявляют a-аминокислоты в этих реакциях.
7. Напишите уравнение реакции аспарагиновой кислоты с ацетатом свинца. К какому типу соединений относится продукт реакции? С катионами какого металла реакция является качественной на a-аминокислотный фрагмент?
8. Напишите реакцию взаимодействия валина с метиловым спиртом в безводной среде. Назовите продукт и покажите практическое применение реакции.
9. Напишите реакции декарбоксилирования in vivo: а) гистидина; б) триптофана; в) глутаминовой кислоты. Назовите продукты и укажите их биологическую активность. Объясните возможность реакций декарбоксилирования у a-аминокислот.
10. Напишите схему образования трипептида из серина, метионина и лизина. Опишите электронное и пространственное строение пептидной связи.
11. Покажите реакции окислительного и неокислительного дезаминирования in vivo аспарагиновой кислоты. Назовите продукты и укажите биологическую роль дезаминирования.
12. Напишите реакции взаимодействия лейцина с: а) формальдегидом; б) азотистой кислотой. С какой целью эти реакции используются в биохимическом анализе?
13. Напишите схемы химической модификации a-аминокислот, находящихся в составе белков:
а) окислительное гидроксилирование;
б) обратимое окисление тиогрупп;
в) карбоксилирование.
Покажите биологическую роль этих процессов.
14. Покажите принципиальный путь биосинтеза катехоламинов.
15. Напишите специфические реакции, протекающие при нагревании a-аминоуксусной и g-аминомасляной кислот. Назовите продукты. Дайте понятие лактим-лактамной таутомерии.
16. Покажите классификацию белков:
а) по биологическим функциям;
б) по составу;
в) по пространственной структуре.
17. Какой цветной реакцией можно доказать наличие:
а) пептидной связи;
б) бензольного кольца в аминокислоте или пептиде;
в) серы в аминокислоте или пептиде?
Лабораторная работа по теме
«Аминокислоты и белки»
Опыт 1. Реакция глицина с формальдегидом
В пробирку поместите 5 капель 1% раствора глицина и добавьте 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавьте равный объем формалина. Отметьте появление красной окраски (кислая среда). Данная реакция под названием «формольное титрование» используется для количественного определения карбоксильных групп в a-аминокислотах.
Вопросы:
1. Напишите уравнение реакции взаимодействия глицина с формальдегидом.
2. Каковы причины изменения окраски индикатора?
3. Какое практическое применение имеет реакция a-аминокислот с формальдегидом?
Опыт 2. Реакция глицина с азотистой кислотой
В пробирку поместить 5 капель 1% раствора глицина и равный объем 5% раствора нитрита натрия. Добавьте 2 капли концентрированной уксусной кислоты и осторожно взболтайте смесь. Наблюдается выделение газа. Реакция используется для количественного определения аминогрупп в аминокислотах.
Вопросы:
1. Напишите схему взаимодействия глицина с азотистой кислотой. Назовите образовавшееся соединение.
2. Какое практическое применение имеет реакция аминокислот с азотистой кислотой?
Опыт 3. Образование комплексной соли меди глицина
В пробирку поместите 1 мл 1% раствора глицина. Добавьте на кончике лопаточки сухой карбонат меди (II) и смесь нагрейте. Раствор окрашивается в синий цвет.
Вопросы:
1. Напишите схему взаимодействия глицина с карбонатом меди (II).
2. Какой цвет характерен для растворов комплексных солей меди (II)?
Опыт 4. Биуретовая реакция на пептидную связь
В пробирку поместите 5-6 капель раствора яичного белка (на общем столе), добавьте равный объем 10% раствора гидроксида натрия и по стенкам добавьте 1-2 капли раствора сульфата меди (II). Наблюдается появление красно-фиолетовой окраски.
Вопросы:
1. Каковы внешние признаки положительной биуретовой реакции?
2. Все ли белки дают биуретовую реакцию?
Опыт 5. Ксантопротеиновая реакция белков
В пробирку поместите 10 капель яичного белка и 2 капли концентрированной азотной кислоты. Содержимое пробирки осторожно нагрейте, все время встряхивая. Раствор и осадок окрашиваются в желтый цвет. Охладив пробирку, осторожно добавьте 1-3 капли 1-% раствора гидроксида натрия до появления ярко-оранжевой окраски.
Вопросы:
1. Какие a-аминокислоты в составе белка можно открыть с помощью ксантопротеиновой реакции?
Опыт 6. Реакция на присутствие серусодержащих
a-аминокислот
В пробирку поместить 10 капель раствора яичного белка и вдвое больший объем 10% раствора гидроксида натрия. Содержимое пробирки перемешайте, нагрейте до кипения (1-2 мин). К полученному щелочному раствору добавьте 5 капель 10% ацетата свинца (II) и вновь прокипятите. Отметьте появление серо-черного осадка.
Вопросы:
1. Напишите в общем виде схему реакции белка с ацетатом свинца.
2. Какие a-аминокислоты в составе белка можно открыть данной качественной реакцией?
Тест № 8
1) лейцин 3) глицин 2) изолейцин 4) лизин 2. Незаменимой α-аминокислотой не являетсяВопросы к зачету по теме «Аминокислоты и белки».
1. Покажите стереоизомерию α-аминокислот на примере серина. Выделите центр хиральности, укажите стандарт, по которому определяют принадлежность… 2. Амфотерность аминокислот. Образование солей по кислотному и основному… 3. Понятие изоэлектрического состояния и изоэлектрической точки α-аминокислоты и белка. Формы существования в…Лабораторно-практическое занятие № 9
Тема: Углеводы. Моносахариды.
Цель: Сформировать знания стереохимического строения, таутомерных форм и важнейших свойств моносахаридов как основу для понимания их метаболических превращений в организме, а также для изучения структурной организации полисахаридов.
Исходный уровень:
1. Энантиомеры. s-Диастереомеры.
2. Относительная конфигурация. D- и L-стереохимические ряды.
3. Механизмы реакций нуклеофильного присоединения (AN) в карбонилсодержащих соединениях.
4. Строение и свойства (гидролиз) полуацеталей и ацеталей.
5. Окисление и восстановление спиртов, альдегидов и кетонов.
Содержание занятия:
1. Контроль выполнения домашнего задания.
2. Практическая часть «Стереоизомерия, цикло-оксо-таутомерия моносахаридов и их реакционная способность».
2.1. Изомерия моносахаридов.
2.2. Химические свойства моносахаридов по оксо- и гидрокси-группам.
2.3. Дезоксисахара.
2.4. Аскорбиновая кислота и ее биороль.
3. Лабораторная работа по теме «Моносахариды».
4. Контроль выполнения лабораторной работы.
5. Контроль усвоения темы.
Углеводы входят в состав клеток и тканей всех растительных и животных организмов и по массе составляют основную часть органического вещества на Земле. В живой природе они имеют большое значение как источники энергии в метаболических процессах; структурные компоненты клеточных стенок растений, бактерий, грибов; составные элементы жизненно важных веществ (нуклеиновые кислоты, коферменты, витамины). Некоторые углеводы и их производные используются как лекарственные средства.
Моносахариды – это полигидроксикарбонильные соединения и их реакционная способность определяется наличием в молекулах этих функций.
Вопросы для самостоятельной работы
1. Назовите источник углеводов для живых организмов и перечислите их функции в организме. 2. Дайте классификацию углеводов по отношению к гидролизу и классификации… 3. Напишите энантиомеры: а) глюкозы; б) галактозы; в) маннозы; г) фруктозы; д) рибозы. Укажите, конфигурация какого…Тест № 9
2. Синтез глюкозы в природе осуществляется реакцией 1)…Лабораторно-практическое занятие № 10
Тема: Углеводы. Олигосахариды. Полисахариды.
Цель: Сформировать знания принципов строения и химических превращений важнейших олиго- и полисахаридов как основу для изучения их биологических функций.
Исходный уровень:
1. Строение и таутомерия моносахаридов.
2. Получение и свойства (гидролиз) O-гликозидов.
3. Восстанавливающие свойства альдогексоз.
Содержание занятия:
1. Контроль выполнения домашнего задания.
2. Практическая часть «Строение и свойства олиго- и полисахаридов».
2.1. Дисахариды – мальтоза, лактоза, сахароза. Строение, свойства и применение.
2.2. Гомополисахариды – амилоза, амилопектин, гликоген, целлюлоза. Строение, свойства и применение.
2.3. Гетерополисахариды – гиалуроновая кислота, хондроитинсульфаты, гепарин. Строение, биороль.
3. Лабораторная работа по теме «Олиго- и полисахариды».
4. Контроль выполнения лабораторной работы.
5. Контроль усвоения темы.
Из олигосахаридов наибольшее значение имеют дисахариды (биозы), состоящие из двух моносахаридных звеньев одинаковой или разной природы. Дисахариды легко гидролизуются с образованием двух молекул моносахаридов. В природе в виде самостоятельно существующих веществ встречается ограниченное число дисахаридов: мальтоза, целлобиоза, лактоза, сахароза.
Дисахариды – это O-гликозиды (полные ацетали), в которых вторая молекула выполняет роль агликона. С ацетальной природой дисахаридов связана их способность гидролизоваться в кислой (но не в щелочной) среде.
Существуют два типа связывания моносахаридных остатков и два типа моносахаридов:
1) за счет полуацетальной (гликозидной) OH-группы одного и любой спиртовой OH-группы другого моносахарида – восстанавливающие дисахариды;
2) за счет полуацетальных (гликозидных) OH-групп обоих моносахаридов – невосстанавливающие дисахариды.
Полисахариды (полиозы) – высокомолекулярные углеводы, представляющие собой продукты поликонденсации моносахаридов. По химической природе их следует рассматривать как полигликозиды (полиацетали). Каждое звено моносахарида связано гликозидными связями с предыдущим и последующим звеньями. При этом для связи с последующим звеном предоставляется полуацетальная (гликозидная) OH-группа, а с предыдущим – спиртовая гидроксильная группа, чаще всего у С-4 или С-6. На конце цепи находится восстанавливающий остаток моносахарида. Поскольку доля концевого остатка относительно всей макромолекулы весьма невелика, то полисахариды проявляют очень слабые восстанавливающие свойства.
Гликозидная природа полисахаридов обусловливает их легкий гидролиз в кислой и высокую устойчивость в щелочных средах. Полный гидролиз полисахаридов приводит к образованию моносахаридов, а неполный – к ряду промежуточных олигосахаридов, в том числе и дисахаридов.
Полисахариды, состоящие из остатков одного моносахарида, называются гомополисахаридами (гликанами), из остатков разных моносахаридов – гетерополисахаридами. Гетерополисахариды, к которым относятся многие животные и бактериальные полисахариды, изучены меньше, однако они играют важную биологическую роль. Это прежде всего полисахариды соединительной ткани - гиалуроновая кислота, хондроитинсульфаты, гепарин. Гетерополисахариды в организме связаны с белками и образуют сложные надмолекулярные комплексы. К гомополисахаридам относятся полисахариды растительного происхождения (крахмал, целлюлоза, пектиновые вещества), животного (гликоген) и бактериального (декстраны) происхождения.
Вопросы для самостоятельной работы
«Олигосахариды. Полисахариды»
1. Приведите строение мальтозы и лактозы. Объясните наличие восстанавливающих свойств и подтвердите эти свойства реакциями.
2. Приведите строение сахарозы и объясните причину отсутствия у нее восстанавливающих свойств. Какую конфигурацию имеют аномерные атомы углерода в остатках D-глюкопиранозы и D-фруктофуранозы?
3. Напишите реакции гидролиза мальтозы и лактозы. В какой среде протекают эти реакции? Укажите гликозидную связь.
4. Напишите реакцию гидролиза сахарозы. Дайте понятие инверсии и объясните причину этого явления.
5. Покажите явление цикло-оксо-таутомерии на примере дисахарида: а) мальтозы; б) лактозы. Укажите восстанавливающий фрагмент молекулы. Объясните, почему свежеприготовленный водный раствор сахарозы не мутаротирует.
6. Напишите реакцию взаимодействия мальтозы с йодистым метилом. Назовите продукт реакции. К какому классу органических соединений он относится?
7. Напишите реакцию взаимодействия молочного сахара (лактозы) с этиловым спиртом в присутствии сухого HCl. Назовите полученное соединение. К какой группе органических соединений оно относится и будет ли способно к гидролизу?
8. Напишите реакцию взаимодействия тростникового сахара (сахарозы) с уксусным ангидридом. Назовите получившийся продукт. К какой группе органических соединений он относится и в какой среде гидролизуется?
9. Какие полисахариды называются гомополисахаридами? Приведите примеры.
10. На какие две фракции делится растительный крахмал? Как они различаются по строению?
11. Из каких моносахаридных звеньев построена молекула амилопектина? Напишите строение фрагмента цепи амилопектина.
12. Из каких моносахаридных звеньев построена амилоза? Назовите характер связи между ними. Напишите строение биозного фрагмента амилозы. Чем объясняется образование окрашенного комплекса амилозы с йодом?
13. Из каких моносахаридных звеньев построен гликоген? Какие отличия имеются в строении животного крахмала – гликогена и фракции растительного крахмала – амилопектина? Напишите строение биозного фрагмента основной цепи гликогена и покажите разветвление цепи. Покажите биологическую роль гликогена.
14. Из каких моносахаридных звеньев построена целлюлоза? Напишите строение биозного фрагмента целлюлозы и назовите характер связи между звеньями.
15. Напишите схему полного расщепления растительного крахмала. Какие вещества называются декстринами? Объясните, почему положительная проба Троммера свидетельствует о полном гидролизе крахмала.
16. Напишите схемы взаимодействий целлюлозы с азотной и уксусной кислотами. Назовите продукты реакций и покажите их применение.
17. Из каких моносахаридных звеньев построена пектовая кислота? Напишите строение биозного фрагмента основной цепи пектовой кислоты. Дайте понятие пектиновых веществ и покажите их применение.
18. Какие полисахариды называются гетерополисахаридами?
Лабораторная работа по теме
«Дисахариды и полисахариды»
Опыт 1. Отсутствие восстанавливающей способности у сахарозы
В пробирку поместите 1 каплю 1% раствора сахарозы и 6 капель 10% гидроксида натрия NaOH. Добавьте для разбавления 5-6 капель воды (высота слоя жидкости 18-20 мм). Прибавьте 1 каплю 2% сульфата меди (II) CuSO4. Образуется прозрачный синий раствор комплексной соли меди (II) с сахарозой. Осторожно нагрейте пробирку над пламенем горелки так, чтобы нагревалась только верхняя часть раствора, а нижняя оставалась без нагревания (для контроля). Нагревайте только до кипения, но не кипятите. Изменение окраски раствора не происходит. Вспомните, что с D-глюкозой в аналогичных условиях происходило изменение окраски верхней части раствора в желто-красную.
Вопросы:
1. Напишите строение сахарозы. Какую конфигурацию имеют аномерные атомы углерода в остатках D-фруктозы и D-глюкозы, входящих в состав молекулы сахарозы?
2. Почему сахароза не способна к цикло-оксо-таутомерии?
3. Объясните причину отсутствия восстанавливающих свойств у сахарозы.
4. Будет ли мутаротировать свежеприготовленный раствор сахарозы?
5. Почему свободная D-глюкоза дает положительную пробу Троммера, а D‑глюкозный остаток в сахарозе этой пробы не дает?
Опыт 2. Восстанавливающая способность лактозы
В пробирку поместите 1 каплю 1% раствора лактозы и 4 капли гидроксида натрия NaOH. Добавьте 1 каплю 2% сульфата меди (II) CuSO4. Образующийся голубой осадок гидроксида меди (II) при встряхивании пробирки растворяется, образуя синий раствор комплексной соли меди (II) с лактозой. Добавьте для разбавления несколько капель воды до высоты слоя жидкости 18-20 мм. Осторожно нагрейте пробирку над пламенем горелки так, чтобы нагревалась только верхняя часть раствора, а нижняя оставалась для контроля (без нагревания). Нагревайте до кипения. При нагревании цвет верхней части раствора изменяется в желто-красный. Вспомните, что с D-глюкозой наблюдается аналогичный результат (проба Троммера положительная), тогда как в опыте с сахарозой в тех же условиях окраска верхней части раствора не изменяется.
Вопросы:
1. Напишите строение лактозы. Какую конфигурацию имеет аномерный атом углерода в остатке D-галактопиранозы?
2. Какой из моносахаридных остатков в молекуле лактозы способен к цикло-оксо-таутомерии?
3. Объясните причину наличия восстанавливающих свойств у лактозы. Напишите уравнение реакции, лежащей в основе пробы Троммера.
Опыт 3. Качественная реакция на крахмал
В пробирку поместить 5 капель 0,5% крахмального клейстера (на общем столе) и 1 каплю сильно разбавленного раствора йода. Раствор окрашивается в синий цвет. Нагрейте раствор, он обесцвечивается; при охлаждении окраска восстанавливается.
Вопросы:
1. Какой дисахарид является структурной единицей амилозы? Какой тип гликозидной связи осуществляется в этом дисахариде между остатками D-глюкозы?
2. Какую конформацию имеет полисахаридная цепь амилозы?
3. Чем объясняется образование окрашенного комплекса амилозы с йодом (соединение включения)?
Тест № 10
1) с гидроксидом калия 3) сероводородом 2) щелочным раствором йода в йодиде калия 4) аммиачным раствором… 2. Восстанавливающие дисахариды реагируютВопросы к зачету по теме «Углеводы».
1. Стереоизомерия на примере глюкозы. Укажите, конфигурация какого атома определяет принадлежность к D- и L-ряду. Назовите конфигурационный… 2. Цикло-оксо-таутомерия моносахаридов на примере: а) глюкозы; б) фруктозы; в) галактозы; г) рибозы.Лабораторно-практические занятия № 11, 12
Цель: Закрепить знания строения и химических свойств основных представителей лекарственных соединений бензольного ряда и физиологически активных… Исходный уровень: 1. Строение гетероциклических соединений – пиррола, имидазола, пиридина, пиримидина, пурина. Электронное строение…Тест № 11
действием 1) никотиновая кислота 3) 5-НОК 2) фтивазид 4) метилсалицилат 2. Новокаин – это производное 1) салициловой кислоты 3) бензойной кислоты 2) …Вопросы к зачету по теме «Физиологически активные гетерофункциональные производные бензольного и гетероциклического ряда».
1. Пара-аминофенол и его производное парацетамол как лекарственные препараты. 2. Пара-аминобензойная кислота как фактор роста микроорганизмов. Фолиевая… 3. Салициловая кислота и препараты на её основе: натрия салицилат, метилсалицилат, аспирин, салол, ПАСК. Строение,…Практическое занятие № 13
Тема: Нуклеотиды. Нуклеиновые кислоты.
Цель: Сформировать знания строения и химических свойств нуклеиновых кислот и их мономерных единиц – нуклеотидов как химическую основу для усвоения различных уровней организации макромолекул нуклеиновых кислот и действия нуклеотидных коферментов.
Исходный уровень:
1. Цикло-оксо- и лактим-лактамная таутомерия.
2. Строение и свойства N-гликозидов.
3. Строение и свойства сложных эфиров.
4. Водородная связь.
Содержание занятия:
1. Контроль выполнения домашнего задания.
2. Практическая часть «Первичная и вторичная структура нуклеиновых кислот – основного звена в биосинтезе белка».
2.1. Пиримидиновые и пуриновые основания, таутомерия.
2.2. Нуклеозиды, нуклеотиды. Принцип построения.
2.3. Первичная структура РНК, ДНК,
2.4. Вторичная структура ДНК.
3. Контроль усвоения темы.
Данный раздел имеет большое значение для изучения биохимии, микробиологии, вирусологии, онкологии, биологии и др.
Необходимость изучения предлагаемой темы в медицинском вузе связана с тем, что без познания строения и свойств таких биополимеров, как нуклеиновые кислоты (НК) и белки, нельзя познать сущность нормальных процессов и патологий, происхождения ряда наследственных заболеваний, подойти к перспективным проблемам управления некоторыми процессами жизнедеятельности.
Проблема передачи наследственности упирается в синтез специфических белков, ответственных за определенные свойства организма. Главным звеном в этом синтезе является дезоксирибонуклеиновая кислота (ДНК). В ее структуре заложен ключ к синтезу белка.
Вопросы для самостоятельной работы
«Нуклеотиды. Нуклеиновые кислоты»
1. Назовите конечные продукты полного гидролиза нуклеиновых кислот.
2. Напишите строение пиримидиновых оснований, назовите их. Для одного основания (любого) покажите лактим-лактамную таутомерию и укажите, в виде каких таутомерных форм основания входят в состав нуклеиновых кислот.
3. Напишите строение пуриновых оснований, входящих в состав нуклеиновых кислот, назовите их. Для одного основания напишите таутомерную форму.
4. Напишите строение нуклеиновых оснований, входящих в состав: а) ДНК; б) РНК. Назовите их. Чем еще различаются по составу ДНК и РНК?
5. Напишите строение тимина, гуанина и комплементарных им оснований. Обозначьте водородные связи между ними.
6. Дайте определение понятия «нуклеозид». Напишите строение аденозина. Покажите N-гликозидную связь. Приведите реакцию гидролитического расщепления аденозина, укажите условия.
7. Напишите строение нуклеозида, в состав которого входит тимин, назовите его. В какой таутомерной форме входит в состав нуклеозида тимин?
8. Дайте определение понятия «нуклеотид». Напишите строение рибонуклеотида с урацилом, назовите его.
9. Напишите схему полного гидролиза цитидин-5¢-монофосфата. Укажите условия, назовите полученные продукты.
10. Из предложенных нуклеотидов выберите и напишите строение входящего в состав только ДНК: уридин-5¢-монофосфат, гуанозин-5¢-монофосфат, тимидин-5¢-монофосфат.
11. Напишите строение участка РНК с последовательностью оснований ЦУГ. Какие существуют виды РНК?
12*. Дайте определение вторичной структуры нуклеиновых кислот. Напишите структуру фрагмента второй цепи ДНК, комплементарного ТАЦ в первой цепи. Что такое антипараллельность цепей.
13. Напишите два мононуклеотида – д-ГМФ и ТМФ и соедините их между собой. Фрагмент ДНК или РНК Вы получили?
14. Напишите схему реакции гидролитического расщепления АТФ, протекающего в организме. Что такое макроэргические связи? Какова биороль АТФ?
15. Напишите строение кофермента НАДÅ и приведите схему окислительно-восстановительной реакции, лежащей в основе его участия в биохимических процессах. Покажите рабочую часть кофермента. Дайте полное название НАДÅ.
16. Напишите строение кофермента НАДФÅ и укажите его биологическую роль. Дайте полное название НАДФÅ.
Тест № 12
2. Лактим-лактамная таутомерия невозможна для 1) урацила 2) гуанина 3) аденина 4) тимина 3. В состав ДНК не входит 1) аденин 2) тимин 3) цитозин 4) урацилВопросы к зачету по теме «Нуклеиновые кислоты».
1. Нуклеиновые основания. Покажите строение и лактим-лактамную таутомерию урацила, тимина, цитозина, гунина. 2. Что такое нуклеозид? Покажите строение и назовите нуклеозиды гуанина,… 3. Что такое нуклеотид? Покажите строение и назовите нуклеозиды цитозина, входящие в состав РНК и ДНК.Список литературы
1. Тюкавкина Н.А., Бауков Ю.И., Зарубян Э.С. Биоорганическая химия: учебник. – М.: ГЭОТАР-Медиа, 2010. – 416 с.
2. Тюкавкина Н.А.. Руководство к лабораторным занятиям по биоорганической химиии. – 4 изд. – М.: Дрофа, 2008. – 318 с.
3. Слесарев В.И. Химия. Основы химии живого. – СПб.: Химиздат, 2001. – 784 с.
Ответы на тестовые задания
| № вопроса № теста | ||||||||||
| 4.1 | ||||||||||
| 4.2 | ||||||||||
ОГЛАВЛЕНИЕ
Введение. 3
Правила по технике безопасности при работе в химической лаборатории. 5
Практическое занятие № 1. 8
Вопросы для самостоятельной работы по теме «Электронное строение элементов-органогенов. Химическая связь в органических соединениях. Изомерия. Номенклатура» 15
Тест № 1. 17
Практическое занятие № 2. 18
Вопросы для самостоятельной работы «Взаимное влияние атомов в органических молекулах». 19
Тест № 2. 21
Вопросы к зачету по теме «Взаимное влияние атомов в органических молекулах (сопряженные системы, сопряжение, ароматичность, электронные эффекты – индуктивный и мезомерный)». 23
Лабораторно-практическое занятие № 3. 24
Вопросы для самостоятельной работы «Реакционная способность углеводородов» 25
Лабораторная работа по теме «Реакционная способность углеводородов». 27
Тест № 3. 28
Вопросы к зачету по теме «Реакционная способность углеводородов». 29
Лабораторно-практическое занятие № 4. 30
Вопросы для самостоятельной работы «Кислотность и основность органических соединений». 31
Тест № 4.1. 33
Вопросы к зачету по теме «Кислотность и основность органических соединений». 35
Вопросы для самостоятельной работы «Гидроксисоединения». 37
Лабораторная работа по теме «Гидроксисоединения». 37
Тест № 4.2. 39
Вопросы кзачету по теме «Гидроксисоединения». 40
Лабораторно-практическое занятие № 5. 41
Вопросы для самостоятельной работы «Оксосоединения». 42
Лабораторная работа по теме «Оксосоединения». 44
Тест № 5. 45
Вопросы к зачету по теме «Оксосоединения». 46
Лабораторно-практическое занятие № 6. 47
Вопросы для самостоятельной работы «Карбоновые кислоты и липиды». 49
Лабораторная работа по теме «Карбоновые кислоты и их производные». 50
Тест № 6. 51
Вопросы к зачету «Карбоновые кислоты и липиды». 52
Лабораторно-практическое занятие № 7. 53
Вопросы для самостоятельной работы «Стереоизомерия». 54
Вопросы для самостоятельной работы «Реакционная способность гидрокси- и оксокислот». 55
Лабораторная работа по теме «Гидрокси- и оксокислоты». 56
Тест № 7. 57
Вопросы к зачету по теме «Основные положения стереоизомерии. Реакционная способность гидрокси- и оксокислот как гетерофункциональных соединений» 59
Лабораторно-практическое занятие № 8. 60
Вопросы для самостоятельной работы «Аминокислоты и белки». 61
Лабораторная работа по теме «Аминокислоты и белки». 63
Тест № 8. 64
Вопросы к зачету по теме «Аминокислоты и белки». 65
Лабораторно-практическое занятие № 9. 66
Вопросы для самостоятельной работы.. 67
«Моносахариды». 67
Лабораторная работа по теме «Моносахариды». 69
Тест № 9. 70
Лабораторно-практическое занятие № 10. 71
Вопросы для самостоятельной работы «Олигосахариды. Полисахариды». 73
Лабораторная работа по теме «Дисахариды и полисахариды». 74
Тест № 10. 76
Вопросы к зачету по теме «Углеводы». 77
Лабораторно-практические занятия № 11, 12. 78
Вопросы для самостоятельной работы «Физиологически активные производные бензольного ряда». 80
Лабораторная работа по теме «Лекарственные вещества на основе бензола» 81
Вопросы для самостоятельной работы «Физиологически активные производные гетероциклического ряда». 84
Лабораторная работа по теме «Физиологически активные гетероциклические соединения». 86
Тест № 11. 87
Вопросы к зачету по теме «Физиологически активные гетерофункциональные производные бензольного и гетероциклического ряда». 88
Практическое занятие № 13. 89
Вопросы для самостоятельной работы «Нуклеотиды. Нуклеиновые кислоты» 90
Тест № 12. 91
Вопросы к зачету по теме «Нуклеиновые кислоты». 93
Список литературы.. 93
Ответы на тестовые задания. 94
УЧЕБНОЕ ПОСОБИЕ ДЛЯ ЛАБОРАТОРНО-ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО БИООРГАНИЧЕСКОЙ ХИМИИ
Составители: К.Г. Галинова, Н.Ф. Гаврилова, Л.Ф. Гейн, И.Н. Глушкова, О.И. Иваненко, И.В. Крылова, И.А. Кожевникова,– Конец работы –
Используемые теги: рекомендуется, качестве, пособия0.057
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Рекомендуется в качестве пособия
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов