рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Одной из первых была предложена водородная шкала атомных масс. Атомные массы всех элементов рассчитывались по отношению к атомной массе водорода.
Реферат Курсовая Конспект
Одной из первых была предложена водородная шкала атомных масс. Атомные массы всех элементов рассчитывались по отношению к атомной массе водорода.
Одной из первых была предложена водородная шкала атомных масс. Атомные массы всех элементов рассчитывались по отношению к атомной массе водорода. - раздел Химия, Основы Химии Это Был...
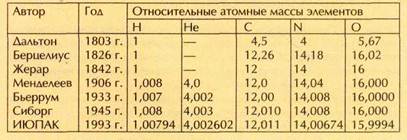
Это была очень интересная и прогрессивная идея. Из неё следовало, как писал Праут, что водород — это та самая «первоматерия» древнегреческих философов, которая путём «конденсации», «сгущения» даёт все остальные элементы. Тем самым подтверждались единство природы, родство всех химических элементов, возможность «расщепить» их на более простые составные части.
Однако после первого восхищения смелой гипотезой энтузиазм большинства химиков начал быстро угасать. Если атомные массы углерода, азота, кислорода, многих других элементов по водородной шкале действительно оказались очень близки к целым числам, то никакими допущениями о неточности эксперимента невозможно было «сделать целой» атомную массу хлора, равную 35,5. По мере совершенствования методов анализа становилось очевидным, что целочисленные атомные массы — скорее не правило, а исключение.

Станислав Канниццаро.
ХИМИЧЕСКАЯ ТЕОРИЯ СТАВИТСЯ НА ГОЛОСОВАНИЕ
В книге «Основы химии» Д. И. Менделеев ярко описал атмосферу Первого международного конгресса химиков: «Присутствовав на этом конгрессе, я хорошо помню, как велико было разногласие... и как тогда последователи Жерара, во главе которых стал итальянский профессор Канниццаро, горячо проводили следствия закона Авогадро. При господстве научной свободы (без неё наука не двигалась бы вперёд, окаменела бы, как в средние века) и при одновременной необходимости научного консерватизма (без него корни прошлого изучения не могли бы давать новых плодов)... истина... при посредстве конгресса, получила более широкое распространение и скоро затем покорила все умы. Тогда сами собою укрепились новые, так называемые жераровские веса атомов и уже с 70-х годов они вошли во всеобщее употребление».
* ИЮПАК (англ. IUPAC — International Union of Pure and Applied Chemistry) — Международный союз теоретической и прикладной химии.
МОРЛИ БЕЗ МАЙКЕЛЬСОНА
Сейчас имя Эдварда Морли вспоминают в основном в связи со знаменитым опытом Майкельсона — Морли, к которому химика Морли привлёк американский физик Альберт Абрахам Майкельсон (1852—1931). Исследователи установили отсутствие так называемого эфирного ветра, из чего следовало постоянство скорости света.
Имея сан священника, Морли очень интересовался «универсальными константами природы», считая, что в них проявляется «благословение Создателя». Среди современников профессор химии Морли прославился главным образом точнейшими определениями атомных масс ряда элементов. Эти его работы связаны с попытками обосновать гипотезу Праута. В 1891 г. несколько американских химиков обратились к Морли с настоятельной просьбой «раз и навсегда разделаться с Праутом». Ответ Морли был уклончивым. Лишь в 1896 г. он опубликовал, пожалуй, главную свою работу «О плотностях кислорода и водорода и об отношении их атомных весов». В том же году Морли избрали президентом самого престижного научного общества страны — Американской ассоциации содействия науке. И вскоре он выступил с обращением к членам ассоциации, названным «Завершающая глава в истории атомной теории». Основываясь на своих экспериментальных данных, Морли заявил, что гипотеза Праута, наконец, окончательно опровергнута.
«ГИПОТЕЗА О СЛОЖНОСТИ ПРОСТЫХ ТЕЛ... ВЕСЬМА УВЛЕКАТЕЛЬНА...»
«Точные исследования, проведённые Стасом... — пишет Менделеев в „Основах химии", — имеют важное значение для разрешения вопроса о том: действительно ли атомные веса элементов могут быть выражены целыми числами, если за единицу атомных весов принять атомный вес водорода. Проут (в транскрипции Менделеева. — Прим. ред.)... высказал такое предположение. Последующие затем определения... показали несправедливость этого заключения... Даже между паем водорода и кислорода не существует, сколько то поныне известно, того простого отношения, какое требуется по гипотезе Проута... Такой вывод прямых опытных исследований нельзя не считать имеющим большее значение, чем предположительная мысль (гипотеза) Проута о кратности между весами атомов элементов, что давало бы повод предполагать (но не утверждать) сложность природы элементов, общность их происхождения из единой первичной материи и ожидать взаимного их превращения друг в друга. Все подобные мысли и ожидания ныне... должно относить к области, лишённой какой-либо опытной опоры, а потому не отвечающими дисциплине положительных сведений естествознания... Достаточно взглянуть на числа, полученные Стасом, и убедиться в точности его определений, особенно приведённых для серебра, чтобы это увлекательное представление если не вполне разрушилось, то сильно поколебалось. Поэтому мы должны отказаться от какого-либо следа уверенности в сложности известных нам простых тел. Это представление не находит подкрепления ни в известных нам превращениях (потому что ни разу ни одно простое тело не было обращено в другое простое тело), ни в соизмеримости атомных весов, свойственных элементам. Её нельзя ни отрицать, ни допускать, по недостатку данных, хотя гипотеза о сложности простых тел и об единстве их всех и весьма увлекательна своею общностью».
Поэтому во второй половине XIX в. гипотезу Праута признали неверной. Решающую роль в этом сыграли, пожалуй, исследования бельгийского химика Жана Серве Стаса (1813— 1891); значительный вклад внёс и американский учёный Эдвард Уильям Морли (1838-1923).
МЕНДЕЛЕЕВ
И ГИПОТЕЗА ПРАУТА
Работая над периодической системой, Менделеев, конечно, задумывался о том, что же представляют собой атомы элементов, возможно ли их превращение друг в друга. Он особо интересовался гипотезой Праута, отмечая, что, как бы ни была она красива, главным судьёй остаётся опыт.
Менделеев дожил до того времени, когда стало возможным наблюдать «сложность простых тел» и превращение одних элементов (радиоактивных) в другие, однако чётких доказательств этому ещё не было. «Рамзай (1903 г.) наблюдал появление спектра гелия в собираемой эманации радия, — писал Менделеев в „Основах химии", — и в этом видят превращение одних элементов в другие. Но, быть может, что гелий просто был в радии и из него при эманации выделяется. Вопрос весьма важен, но его точное опытное расследование невозможно, пока радий не будет доступен для исследований в количествах, допускающих точные измерения». Более того, были сомнения даже в существовании радия как самостоятельного элемента: «К. Винклер, — отмечал Менделеев, — не находил существенных химических различий между препаратами радия и бария и, хотя атомный вес радия по существующим определениям явно превосходит атомный вес бария, всё же имеется основание полагать, что причина различия здесь такова же, как между железом намагниченным и лишённым магнитности».
Тем не менее, по словам Менделеева, многие учёные старались применить его периодический закон для
оправдания гипотезы о сложности простых веществ (фактически — о сложности атомов) — гипотезы, «взятой из той глубокой древности, когда находили удобным признавать много богов, но единую материю». В настоящее время гипотеза Праута фактически подтвердилась: все элементы действительно образовались в процессах ядерного нуклеосинтеза в звёздах из ядер атомов водорода — протонов, а также нейтронов.
АТОМНЫЕ МАССЫ: РОЖДЕНИЕ КИСЛОРОДНОЙ ЕДИНИЦЫ
В I860 г. Стаc предложил изменить атомную единицу массы. Со времён Дальтона за неё чаще всего принимали массу атома водорода. Это было не очень удобно, поскольку большое число элементов, в частности многие металлы, не образуют с водородом устойчивых соединений. Значительно проще анализировать многочисленные соединения различных элементов с кислородом (или хлором) и таким образом находить их относительные атомные массы. Пока стандартом оставался атом водорода, полученные значения пересчитывали, используя известное соотношение масс Н и О. И тут не возникло бы никаких проблем, если бы данное соотношение было известно с высокой точностью. Однако, как уже отмечалось, оно постоянно уточнялось. Впервые достаточно точно отношение масс кислорода и водорода в воде определил в 1842 г. французский химик Жан Батист Андре Дюма, по данным которого оно составило 7,98. Эдвард Морли в 1885 г. получил значение 7,9396; американский физик Кеннет Бейнбридж в 1933 г. — 7,9383; современное же значение — 7,9367. После каждого такого уточнения приходилось пересчитывать атомные массы почти всех известных элементов!
Поэтому предложение Стаса принять в качестве стандарта атом кислорода представлялось разумным. Тогда любое последующее уточнение
«Я НЕ ДОПУСКАЮ НИ АТОМА, НИ МОЛЕКУЛЫ»
Атомистическая гипотеза в химии утверждалась медленно и с трудом, хотя для этой науки понятие атома — основное, и без него, казалось бы, она развиваться не может. Однако лаже крупнейшие химики высказывались скептически на сей счёт. Так, знаменитый французский химик-органик Марселен Бертло писал: «Понятие молекулы, с точки зрения наших знаний, неопределённо, в то время как другое понятие — атом — чисто гипотетическое». Известный французский химик Анри Этьен Сент-Клер Девилль (1818—1881) без обиняков заявлял: «Я не допускаю ни закона Авогадро, ни атома, ни молекулы, ибо я отказываюсь верить в то, что не могу ни видеть, ни наблюдать». А немецкий учёный Вильгельм Оствальд, один из основателей физической химии, даже в начале XX в. решительно отрицал существование атомов! «То, что мы называем материей, — утверждал он, — является лишь совокупностью энергий, собранной воедино в данном месте». В своём трёхтомном учебнике химии Оствальд ухитрился ни разу не употребить слово «атом».

– Конец работы –
Эта тема принадлежит разделу:
Основы Химии
На сайте allrefs.net читайте: "Основы Химии"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Одной из первых была предложена водородная шкала атомных масс. Атомные массы всех элементов рассчитывались по отношению к атомной массе водорода.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов