рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
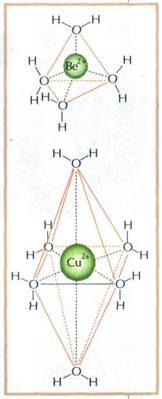
- Строение гидратных оболочек ионов в водных растворах.
Реферат Курсовая Конспект
Строение гидратных оболочек ионов в водных растворах.
Строение гидратных оболочек ионов в водных растворах. - раздел Химия, Основы Химии Наприме...

Например, соль Пейроне, по Вернеру, имеет цис-строение (одинаковые лиганды — соседи), а соль Рейзе — транс-строение (соседствуют разные лиганды).
Второе наиболее распространённое координационное число — 6: лиганды располагаются в вершинах октаэдра. И в этом случае Вернер объяснил различные свойства комплексов их пространственным строением. Например, комплексному катиону [Co(NH3)4(NO2)]+ (степень окисления кобальта +3) красно-жёлтого цвета учёный приписал транс-строение (группы NO2 находятся в противоположных вершинах октаэдра), а аналогичному по составу комплексу жёлто-коричневого цвета — цис-строение (те же группы расположены в соседних вершинах).
В дальнейшем Вернер продолжал совершенствовать свою теорию. Так, он признал, что между главной и побочной валентностями фактически нет различий: все связи между центральным атомом и лигандами равноценны. Однако объяснить, например, каким образом атом никеля может образовать четыре одинаковых связи в комплексном карбониле [Ni(CO)4], во времена Альфреда Вернера было невозможно. Для этого потребовались многочисленные эксперименты и новые теоретические работы, приведшие к современному пониманию природы химической связи (см. статью «Химическая связь»).
ЦЕНТРАЛЬНЫЕ АТОМЫ И ЛИГАНДЫ
Роль центрального атома в комплексе способен играть любой элемент. Чаще всего это переходные металлы, степень окисления которых может быть различной, даже отрицательной. Так, например, хром проявляет все степени окисления от —2 до +6: Na2[Cr(CO)5], Na2[Cr2(CO)10], Cr(CO)6, K3[Cr(CN)4], [Cr(NH3)6]Cl2, [Cr(H2O)6]Cl3, K2[CrF6], K3[СrО4], K2[СrО4].
Неметаллы, выступающие в качестве центральных атомов, тоже могут
иметь разную степень окисления. Так, кремний(IV) образует фторосиликат K2[SiF6]; хлор(0) — гидрат [Сl2•(Н2О)б], полученный ещё Фарадеем; иод, помещённый в раствор иодида калия, — комплекс К[I(I2)3], в котором центральный атом имеет степень окисления -1.
В качестве нейтральных лигандов чаще всего выступают СО, Н2О и NH3 (они входят в состав карбонилов, аквакомплексов и аммиакатов соответственно). Возможны и смешанно-лигандные комплексы, например [Cu(NH3)4(H2O)2]2+. Известно множество незаряженных органических лигандов: амины RNH2, фосфины R3P, ароматические соединения (бензол, пиридин) и т. д. Чаще же встречаются заряженные лиганды: галогениданионы, ОН-, CN-, NO2-, ONO- и т. д.
Последний случай демонстрирует изомерию лиганда. Другой пример — группа SCN-, которая в зависимости от центрального металла может присоединяться к нему либо атомом серы (тиоцианатные комплексы), либо атомом азота (изотиоцианатные комплексы). Лиганды, которые образуют лишь одну связь с центральным ионом, называются монодентатными (от греч. «монос» — «один» и лат. dentis — «зуб»).
Известно и множество полидентатных лигандов, которые могут занимать сразу несколько координационных мест. Если они координируются одним и тем же центральным атомом, образуются комплексы, которые называются халатными (от греч. «хеле» — «клешня»): лиганды как бы обхватывают центральный атом, подобно клешням краба. Так, диметилглиоксим
СН3—C(=N—ОН)—C(=N—ОН)—СН3
(реактив Чугаева) служит аналитическим реагентом на никель: он образует с ионами Ni2+ малиново-красный хелатный комплекс.
Один из самых известных лигандов — натриевая соль этилендиаминтетрауксусной кислоты (другие названия: ЭДТА, комплексон III, хелатон III, трилон Б). Для связи с центральным атомом этот лиганд может
использовать до шести центров: четыре атома кислорода карбоксильных групп СОО- и неподелённые пары электронов двух атомов азота. ЭДТА легко связывает ионы Са2+ и Mg2+ в растворе и таким образом делает воду «мягкой». Известно, что тяжёлые металлы, например медь, даже в ничтожных концентрациях (разбавление в миллион раз) ускоряют окисление витамина С кислородом воздуха. В присутствии же всего 0,01% ЭДТА ионы металлов связываются так прочно, что не оказывают больше никакого вредного воздействия. Поэтому ЭДТА (под кодом Е386) применяют в пищевой промышленности в качестве консерванта и антиокислителя.
Как видим, комплексные соединения уже давно не считаются химической экзотикой, а их практическое применение расширяется с каждым годом.
Более того, без них немыслима жизнь. Лиганды (в виде органических гумусовых кислот) содержатся в почве. С их помощью нерастворимые соединения кальция, железа, других элементов переходят в растворимую форму и усваиваются растениями.
Например, на Гавайях есть плоскогорье, где почва окрашена в красный цвет, так как содержит более 20% оксида железа Fe2O3. Тем не менее растущие там ананасы страдают от недостатка железа. В такую почву надо вносить не железо, а комплексоны, которые переведут его в растворимую форму.
Наша кровь содержит комплексное соединение железа — гемоглобин, в нём атом железа, имея одну «координационную вакансию», может связываться с молекулой кислорода. При железодефицитной анемии (малокровии) количество гемоглобина в крови снижается. Для лечения назначают приём препаратов железа. Наиболее эффективны те, в которых железо связано в комплекс, например с аскорбиновой кислотой или никотинамидом (витамин РР). Похожий на гемоглобин комплекс есть и в зелёных растениях: если атом железа заменить атомом магния, получится основная часть хлорофилла. Связанные в комплексы ионы кобальта, молибдена, меди присутствуют в ферментах, без которых не может функционировать ни один живой организм.
ПСЕВДОНИМЫ
Не зная состава различных веществ, алхимики давали им произвольные названия, нередко очень длинные, неудобные для произношения и трудно запоминаемые. Одно и то же вещество могло иметь несколько имён. Например, к концу XVIII в. для сульфата меди существовало четыре названия, для карбоната меди — десять, для углекислого газа — двенадцать.
Некоторые названия химики ещё помнят, другие канули в Лету, и даже не всякий специалист по истории науки скажет, что такое «пригорело-древесная соль» (а это ацетат кальция, извлекаемый из продуктов сухой перегонки древесины) или «философская шерсть» (оксид цинка, который алхимики получали в виде рыхлого
порошка). А взять описания химических процедур... В работах М. В. Ломоносова, например, встречается выражение «распущенный подонок», что
КАЛИЙ ХЛОРОВИЧ И ДРУГИЕ
С разработкой системы названий химических соединений связаны и анекдотические истории. В 1870 г. комиссия по химической номенклатуре Русского физико-химического общества обсуждала предложение одного химика называть соединения по тому же принципу, по какому в русском языке строятся имена, отчества и фамилии. Например: Калий Хлорович (KCl), Калий Хлорович Кислов (КСlO3), Хлор Водородович (HCl), Водород Кислородович (Н2О). После долгих прений комиссия постановила: отложить обсуждение до января, правда, не указав при этом, какого года. С тех пор к этой теме больше не возвращались.

может смутить нынешнего читателя, хотя в современных поваренных книгах порой рекомендуют распустить (т. е. растворить) сахар в воде, а слово «подонок» в старину означало «осадок».
В конце XVIII в. А. Л. Лавуазье возглавил комиссию по созданию новой химической номенклатуры (лат. nomenclatura — «роспись имён»). В химии так называют систему правил, с помощью которых каждому веществу можно дать имя и, наоборот, зная название, записать его химическую формулу. Разработать единую, однозначную, простую и удобную номенклатуру — дело непростое. Даже сегодня мнения химиков на этот счёт расходятся.
По предложению Лавуазье новые названия дали химическим элементам, а также сложным веществам с учётом их состава, особенностей химических свойств. Так, элемент, который ранее Дж. Пристли именовал «дефлогистированным воздухом», К. В. Шееле — «огненным воздухом», а сам Лавуазье — «жизненным воздухом», по новой номенклатуре стал кислородом (тогда считали, что он обязательно входит в состав кислот). Кислоты получили названия по соответствующим элементам; в результате «селитряная дымистая кислота» превратилась в азотную, а «купоросное масло» — в серную. Для обозначения солей стали использовать названия кислот и соответствующих металлов (или аммония).
Принятие новой химической номенклатуры позволило систематизировать обширный фактический материал, что чрезвычайно облегчило изучение химии. Основные принципы, заложенные Лавуазье, сохранились до наших дней. Тем не менее и сами химики, и, особенно, непрофессионалы часто употребляют так называемые тривиальные (от лат. trivialis — «обыкновенный») названия, причём порой неверно. Так, например, говорят, что человеку, который почувствовал себя плохо, дают «понюхать нашатыря». Но ведь нашатырь (хлорид аммония) — соль без запаха! В данном случае это вещество путают
с нашатырным спиртом, который действительно имеет резкий запах и возбуждает дыхательный центр.
Массу тривиальных названий химических соединений используют художники, технологи, строители (охра, сурик, киноварь, глёт, пушонка и т. д.). В медицинских справочниках можно встретить до десятка и более различных синонимов для одного и того же препарата, который фирмы-производители в разных странах именуют по-своему (например, отечественный пирацетам — он же импортный ноотропил; венгерский седуксен — он же польский реланиум).
Среди химиков распространены «именные» названия многих соединений, особенно комплексных солей. Скажем, соль Цейзе K[Pt(C2H4)Cl3]•Н2О названа в честь датского химика Вильяма Цейзе (1789—1847), который в 1827 г. неожиданно для себя открыл соединение платины, содержащее органическое вещество этилен. Такие названия более удобны, чем полные научные. Так, вместо «нитрозодисульфонат калия» химик скажет «соль Фреми», вместо «гексагидрат двойного сульфата аммония-железа(П)» — «соль Мора» и т. д.
По современным правилам химической номенклатуры неорганических соединений каждое вещество получает согласно его формуле систематическое название, например: О, — дикислород, О3 — трикислород, Р4О10 — декаоксид тетрафосфора, Н3РО4 — тетраоксофосфат(V) водорода, BaSO3 — триоксосульфат(IV) бария, Cs2Fe(SO4)2 — тетраоксосульфат железа(П)-дицезия и т. д. Правда, нередко такое наименование трудно выговаривать, поэтому для некоторых распространённых соединений (кислот, их солей и т. д.) считаются допустимыми традиционные названия: O2 — кислород, О3 — озон, Н3РО4 — ортофосфорная кислота, BaSO3 — сульфит бария. Но поскольку они не дают точного представления о составе химического соединения, для перехода от таких названий к формулам и наоборот требуются хорошая память и определённый навык.

– Конец работы –
Эта тема принадлежит разделу:
Основы Химии
На сайте allrefs.net читайте: "Основы Химии"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Строение гидратных оболочек ионов в водных растворах.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов