рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Теодор Уильямс Ричардс.
Реферат Курсовая Конспект
Теодор Уильямс Ричардс.
Теодор Уильямс Ричардс. - раздел Химия, Основы Химии Парадоксы Атомных Масс Если Сравнить Относительные Атомные Массы Эл...
ПАРАДОКСЫ АТОМНЫХ МАСС
Если сравнить относительные атомные массы элементов Аr в таблице Менделеева, можно обнаружить некоторые, на первый взгляд, «странности». Одна из них — разная степень точности представленных данных. Например, современное значение Аr для С содержит пять значащих цифр, для О — шесть, для Al и Р — по семь, для F — девять, тогда как для Zn, Ge, Li, Se, Kr, Mo, Ni, Pb, Sr, Ti — лишь по четыре. Почему?
Оказывается, точность, с которой определяется относительная атомная масса элемента, зависит не только от тщательности измерений, но и от непостоянства его изотопного состава. В разных образцах соотношение изотопов не вполне одинаковое: лёгкие изотопы могут концентрироваться в одних породах, тяжёлые — в других. Поэтому давать очень точные значения атомных масс просто не имеет смысла. Кстати, по точности, с какой приводятся атомные массы, можно сразу сказать, происходит ли в природе «разделение изотопов» данного элемента, и насколько сильно.
Вторая «странность» заключается вот в чём. Относительные атомные массы, рассчитанные по «физической кислородной шкале» и углеродной, различаются. Хотя, казалось бы, они должны быть совершенно одинаковыми, так как при определении единицы измерения в первом случае делили массу атома 16О (8 протонов, 8 нейтронов, 8 электронов) на 16, а во втором — массу атома 12С (6 протонов, 6 нейтронов, 6 электронов) на 12.
Однако в действительности всё не так: 1/12 массы атома 12С больше 1/16 массы атома 16О! При образовании ядра слиянием протонов и нейтронов выделяется огромная энергия. В соответствии с уравнением Эйнштейна Е=mс2 (с — скорость света), выделившаяся энергия Е «уносит» с собой часть массы т. Следовательно, масса нового атома не равна сумме масс его составляющих. Разница в массах (её назвали дефектом массы) может быть заметной — почти 1% для некоторых атомов. Больше всего «худеют» при образовании атомы с массовым числом около 50 (середина четвёртого ряда элементов в периодической системе). До этих элементов дефект массы растёт с увеличением атомного номера, после них — постепенно падает. Для 16О дефект массы больше, чем для 12С. Вот почему кислородная и углеродная единицы не совпадают.
И наконец, остановимся ещё на одной «странности» атомных масс. Известно, что природный водород представлен двумя стабильными нуклидами с массовыми числами 1 и 2 (99,984 % 1Н и 0,016% 2Н), поэтому Аr(Н) немного больше 1. Гелий также представлен двумя стабильными нуклидами с массовыми числами 3 и 4, причём 3Не в природе всего 0,00013%. Однако Ar(Не) не меньше, а больше 4. С другой стороны, кислород в природе — это смесь трёх стабильных нуклидов: 16О, 17О и 18О. Но Ar(О)=15,9994, т. е. меньше 16. Всё это — проявления дефекта массы, а также следствие того факта, что массы протона и нейтрона больше 1 а. е. м.
Для иллюстрации дефекта массы просуммируем массы покоя двух электронов, двух протонов и двух нейтронов
в атоме 4Не: 2mp+2mn+2me=2•1,00728+2•1,00867+2х 0,00055 = 4,0330. Но на самом деле из-за дефекта массы Аr (4Не) = 4,0026 — и всё же больше 4. Итак, при образовании атомов из отдельных частиц обычная арифметика «не работает».
Теперь не покажется удивительным, что точные массы трёх изотопов кислорода в углеродных единицах составляют соответственно 15,9949; 16,9991 и 17,9992 и не равны массовым числам (т. е. 16, 17 и 18), а усреднённая масса кислорода, рассчитанная из этих значений с учётом распространённости изотопов в природе, как раз и равна 15,9994.
Для атомов углерода дефект массы тоже существует: он больше, чем у гелия и меньше, чем у кислорода. Однако Аr (12С) принята равной 12.
«Парадоксальные» относительные атомные массы можно найти и у других элементов — F, P, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pr, Tb, Ho, Tm, Lu, Au, Bi, U, Th. Из них только у лютеция и урана имеются два или три стабильных (или очень долгоживуших) изотопа, остальные — элементы-одиночки с единственным стабильным изотопом, и для них дефект массы выявляется наиболее наглядно. Так, атомная масса марганца меньше 55 и равна 54,9380.
Несмотря на то что дефект массы несколько «портит» стройную гипотезу Праута, вряд ли сам учёный, живи он в наши дни, был бы этим огорчён. Скорее наоборот: он считал бы, что его гипотеза восторжествовала. Действительно, атомы (вернее ядра) любого химического элемента построены из целого числа простейших «кирпичиков» — протонов и нейтронов.
ской кислородной единицей» физики ввели свою, «физическую кислородную единицу». Она определялась как 1/16 массы нуклида 1бО, а эта масса, разумеется, уже была вполне определённой и не подверженной никаким колебаниям. По физической шкале атомная масса природного кислорода получалась равной 16,0044. Так в течение многих лет и сосуществовали две единицы измерения — очень точная физическая и менее точная химическая. Это, естественно, создавало определённые неудобства. Конечно, химики могли перейти на «строгую» физическую кислородную шкалу — но для этого им пришлось бы увеличить значения атомных масс всех элементов в 1,000275 раза (или на 0,0275%). После долгих
дискуссий в 1959 г. было принято другое решение: и физики, и химики в качестве единицы вместо 1/16 массы атома 16О выбрали 1/12 массы атома 12С. Причин для этого оказалось достаточно. Во-первых, введение углеродной шкалы вызвало необходимость уменьшить значения всех атомных масс всего лишь в 1,000043 раза (или на 0,0043%). Таким образом, примерно для половины химических элементов относительные атомные массы остались практически прежними, а для остальных изменились весьма незначительно (например, для кислорода с 16,0000 до 15,9994). Во-вторых, атомы углерода — основа огромного числа органических соединений, а атомная масса углерода какой была (12,011), такой по новой шкале и осталась. Атомная масса водорода — второго по значению элемента в органической химии — также практически не изменилась, что очень упрощало многочисленные расчёты по результатам анализов органических соединений. Наконец, с экспериментальной точки зрения нуклид 12С более удобен для точных измерений масс, чем 16О. В I960 г. новую углеродную единицу принял Международный союз теоретической и прикладной физики (ИЮПАП), а в 1961 г. — ИЮПАК.
В честь Джона Дальтона современную атомную единицу массы (а. е. м.), или углеродную единицу (у. с), называют иногда дальтоном и обозначают D (или Da); 1 D=1,66054•10-27 кг. В дальтонах биохимики часто измеряют массы больших молекул, например белков и нуклеиновых кислот.
«ФАМИЛЬНОЕ ДРЕВО» НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Многие простые тела существуют в различных видоизменениях, а элемент есть нечто, изменению не подлежащее. Так, углерод является в виде угля, графита и алмаза, которые суть различные тела, притом простые, а элемент один. Тот же углерод содержится и в углекислом газе, но в нём нет ни угля, ни графита, ни алмаза.
Д. И. Менделеев. «Основы химии»
Химия, как и любая другая наука, имеет свой особый язык Это язык химических символов, формул и уравнений реакций. Каждое химическое соединение записывается в виде формулы, показывающей, атомы каких элементов и в каком количестве в нём присутствуют.
В настоящее время известно около 500 тыс. неорганических веществ. Знать все их формулы и названия, не говоря уже о свойствах, практически
невозможно. Чтобы легче ориентироваться в мире химии, всё это многообразие веществ подразделено на отдельные классы, включающие соединения, сходные по строению и свойствам.
Первой ветвью «фамильного древа» неорганической химии является класс простых веществ, состоящих из атомов одного элемента (например, кислород О2, азот N2, железо Fe и т. д.).
Простые вещества подразделяют на металлы и неметаллы. Металлы — это твёрдые при комнатной температуре вещества (за исключением ртути), с металлическим блеском, высокой тепло- и электропроводностью, Кристаллическая решётка металлов состоит из атомов. Носителями тока в них являются свободные электроны (так называемый электронный газ). Атомы металлов содержат на внешнем электронном уровне небольшое число электронов, которые они отдают в результате химических реакций, т. е. металлы являются восстановителями. Металлические свойства в наиболь-

*Способность элемента существовать в виде нескольких форм, различающихся строением и свойствами (но не составом), называется полиморфизмам, а эти формы — полиморфными модификациями (кристобалит и кварц, a-Fe и g-Fe). Под аллотропией понимают способность элемента образовывать несколько простых веществ — аллотропных модификаций (алмаз, графит и фуллерен С60; кислород и озон). Если простые вещества построены из одинаковых структурных единиц, то к ним также применим термин полиморфизм (алмаз и графит, но не алмаз и фуллерен С60).
шей степени выражены у элементов главной подгруппы первой группы периодической системы (щелочных металлов).
Типичные неметаллы — полная противоположность металлам. К ним относятся вещества, состоящие из молекул (газы, жидкости, легколетучие твёрдые вещества). Но некоторые неметаллы имеют и немолекулярное строение (красный фосфор, алмаз), они отличаются высокой температурой плавления и кипения. Неметаллы, за редким исключением, — плохие проводники тепла и электричества. Они являются полупроводниками или диэлектриками.
Помимо типичных металлов и неметаллов есть большая группа простых веществ с промежуточными свойствами — металлоидов. К ним относятся мышьяк, сурьма, висмут, селен и многие другие.
Среди сложных веществ, или химических соединений, обычно выделяют четыре основных класса: оксиды, кислоты, основания и соли. Эта классификация разработана выдающимися химиками XVIII—XIX столетий А. Л. Лавуазье, М. В. Ломоносовым, Й. Я. Берцелиусом, Дж. Дальтоном.
Оксиды (в русской химической традиции — окислы) — соединения элементов с кислородом, например оксид фосфора(V) Р2О5, оксид кальция СаО. У большинства элементов они образуются при взаимодействии простых веществ с кислородом воздуха. Оксиды металлов — преимущественно ионные соединения, характеризующиеся высокими температурами плавления (некоторые из них при сильном нагревании разлагаются на металл и кислород). Оксиды неметаллов, как правило, имеют молекулярное строение. Оксиды следует отличать от пероксидов — производных пероксида водорода Н2О2, в которых имеется связь О—О, например Na2O2, BaO2 и т. д.
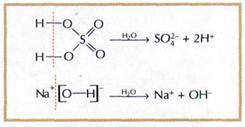
Кислоты — вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка. Они обычно подразделяются на кислородсодержащие (серная кислота H2SO4, ортофосфорная кислота
– Конец работы –
Эта тема принадлежит разделу:
Основы Химии
На сайте allrefs.net читайте: "Основы Химии"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Теодор Уильямс Ричардс.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов