рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- СОЕДИНЕНИЯ В КВАДРАТНЫХ СКОБКАХ. КОМПЛЕКСЫ
Реферат Курсовая Конспект
СОЕДИНЕНИЯ В КВАДРАТНЫХ СКОБКАХ. КОМПЛЕКСЫ
СОЕДИНЕНИЯ В КВАДРАТНЫХ СКОБКАХ. КОМПЛЕКСЫ - раздел Химия, Основы Химии Как Всё Начиналось В Начале Xviii В. Красильный Мастер Дисбах В Берл...
КАК ВСЁ НАЧИНАЛОСЬ
В начале XVIII в. красильный мастер Дисбах в Берлине приобрёл у торговца необычный поташ (карбонат калия), растворы которого с солями железа давали синее окрашивание. Оказалось, что поташ был ранее прокалён с бычьей кровью. Так открыли новую краску, названную берлинской лазурью. Но лишь гораздо позднее стало понятно, какие же химические процессы приводят к её образованию. Животные остатки, в том числе и кровь, содержат азот и серу. Карбонат калия прокаливали с сухой кровью в больших чугунных сосудах, в которые специально добавляли железные опилки или стружки. В этих условиях карбонат частично превращается в цианид KCN, а сера даёт с железом сульфид FeS. При обработке смеси горячей водой идёт реакция 6KCN + + FeS=K4[Fe(CN)6]+K2S. Её продукты — сульфид калия и соединение, которое в своё время назвали жёлтой кровяной солью (химическое название — гексацианоферрат(П) калия). А слово «цианид» происходит от греческого «кианос» — лазурный.
При взаимодействии жёлтой кровяной соли с солями железа(III) и образуется берлинская лазурь. Состав растворимой формы краски отвечает формуле K[Fe3+Fe2+(CN)6], а нерастворимой — Fe4[Fe(CN)6]3.
При окислении K4[Fe(CN)6] хлором получается ещё одна «кровяная соль» — красная K3[Fe(CN)6], или гексацианоферрат(III) калия. Красную кровяную соль называют также солью

Красильня. Гравюра из «Энциклопедии» Д. Дидро. XVIII в.
*Жёлтая K4[Fe(CN)6] и красная K3[Fe(CN)6] кровяные соли (вещества бледно-жёлтого и тёмно-красного цвета соответственно) являются солями гексацианожелезных (железисто-и железосинеродистой) кислот H4[Fe(CN)6] и H3[Fe(CN)6], выделенных в твёрдом виде в форме сольватов с эфиром.


Растворы сульфата никеля NiSO4 и сульфата гексаамминникеля [Ni(NH3)6]SO4.

Растворы сульфата меди(II) CuSO4 и сульфата
тетраамминдиаквамеди [Cu(NH3)4(H2O)2]SO4.
Гмелина — в честь открывшего её в 1822 г. немецкого учёного Леопольда Гмелина (1788—1853), который известен всем химикам мира как составитель самого полного справочника по неорганической химии (сам Гмелин написал два тома; сейчас же объём справочника превышает 300 томов!). Синее вещество, образующееся при смешении растворов железного купороса и соли Гмелина, назвали турнбулевой синью (в «Основах химии» Д. И. Менделеева она упоминается как турнбульская лазурь) — по имени одного из основателей фирмы «Артур и Турнбуль», занимавшейся в конце XVIII в. изготовлением красителей для тканей в предместье Глазго (Шотландия).
Как выяснилось впоследствии, обе «лазури» имеют одинаковый состав. Это связано с тем, что при смешении растворов, содержащих ионы Fe2+ и [Fe(CN)6]3-, один электрон с иона Fe2+ переходит к иону [Fe(CN)6]3-, и в результате образуется соединение, идентичное по составу берлинской лазури. В его кристаллической решётке ионы Fe+3 и Fe+2 находятся в пустотах между цианид-ионами. При записи формул кровяных солей и берлинской лазури химикам понадобились квадратные скобки, чтобы подчеркнуть особенность их строения.
СОЕДИНЕНИЯ
«СО СТРАННОСТЯМИ»
В XIX в. в химии было накоплено большое число фактов, необъяснимых с точки зрения существовавшей
тогда теории валентности. Многие вещества, в которых элементы, казалось бы, уже полностью использовали свои валентности, сохраняют способность к дальнейшему присоединению различных ионов и молекул. При этом новые, «незаконные» (с точки зрения теории) связи оказываются не менее прочными, чем «обычные» валентные связи. Некоторые из вновь открытых соединений были названы двойными солями (например, 3KF•AlF3), другие — аммиакатами (CuSO4•4NH3 третьи — кристаллогидратами (CuСl2•6Н2О) и т. д.
Необычность поведения подобных веществ можно продемонстрировать на примере соединений «четырёхвалентной» платины: PtCl4•2NH3, PtCl4•4NH3, PtCl4•6NH3 и PtCl4•2KCl. Несмотря на внешнее сходство, они резко различаются по свойствам. Так, первое из них в растворе практически не распадается на ионы (раствор не проводит электрический ток). Отсутствие хлорид-ионов подтверждает и качественная реакция: при взаимодействии раствора с нитратом серебра осадка AgCl не выпадает.
Второе соединение образует растворы с высокой электропроводностью: в воде оно распадается на три иона. Нитрат серебра осаждает из таких растворов только два атома хлора из четырёх.
В третьем соединении все четыре атома хлора осаждаются из водных растворов нитратом серебра; значение электропроводности растворов показывает, что соль распадается на пять ионов.
В четвёртом соединении, как и в первом, нитрат серебра вовсе не осаждает хлора, однако растворы этого вещества проводят ток, причём степень электропроводности указывает на образование трёх ионов из каждой исходной молекулы. А специальными обменными реакциями можно обнаружить ионы калия.
По приведённым «молекулярным» формулам такое поведение предсказать было невозможно. Более того, обнаруживались всё новые факты, не поддававшиеся объяснению с помощью классической теории валент-
ности. Так, соль Пейроне и соль Рейзе одинакового состава PtCl2•2NH3 различались цветом, растворимостью и другими свойствами. Крупнейший русский химик Лев Александрович Чугаев, получивший мировое признание за работы по химии комплексных соединений, писал, что эта область «по своей запутанности, по противоречивости фактических данных и отсутствию какой-либо общей руководящей идеи казалась совершенно безнадёжной для систематической разработки».
ТЕОРИЯ ВЕРНЕРА
Такой «общей руководящей идеей» стала разработанная к 1893 г. швейцарским химиком Альфредом Вернером теория строения комплексных (или координационных) соединений.
Вернер разделил все неорганические вещества на так называемые соединения первого и высшего порядка. К соединениям первого порядка он отнёс главным образом достаточно простые по своей структуре вещества (Н2О, NaCl, PCl3). Соединениями высшего порядка учёный предложил считать продукты взаимодействия между собой соединений первого порядка — кристаллогидраты, аммиакаты, полисульфиды, двойные соли, а также комплексные соединения.
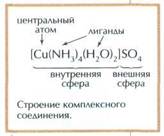
Комплексное соединение, по Вернеру, должно иметь в своей структуре центральный атом (ион), который равномерно окружён различными ионами или нейтральными молекулами, позднее их назвали лигандами (от лат. ligare — «связывать»). Число донорных атомов лигандов, непосредственно связанных с центральным атомом, называется его координационным числом.
Вернер предложил в каждом комплексе различать две координационные сферы: внутреннюю и внешнюю. При записи состава комплексных соединений принято центральный атом вместе со всеми ионами и молекулами, входящими во внутреннюю сферу, заключать в квадратные скобки. Вне скобок остаются лишь внешнесферные ионы, нейтрализующие за-
ряд комплексного иона; в ряде комплексов внешняя сфера может и отсутствовать.
Именно внешние ионы при растворении комплексного соединения в воде легко отщепляются и находятся в растворе самостоятельно, обусловливая (совместно с комплексным ионом) его электропроводность. Лиганды внутренней координационной сферы связаны с центральным атомом настолько прочно, что, по меткому выражению Вернера, словно бы «исчезают» внутри комплекса, никак себя не проявляя ни в аналитических реакциях, ни в электропроводности раствора. Именно поэтому комплексными Вернер назвал соединения, устойчивые в растворах и не проявляющие свойств исходных для них соединений первого порядка. Например, ионы хлора не осаждаются нитратом серебра, а аммиак не пахнет.
Теперь можно объяснить странные свойства четырёх рассмотренных соединений платины, которые ставили в тупик многих химиков XIX столетия. В первом комплексе [PtCl4(NH3)2] нет внешних ионов, поэтому его раствор не проводит ток. Во втором комплексе два иона хлора находятся во внутренней сфере, а два — во внешней, так что в растворе соединение даёт три иона: [PtCl2(NH3)4]Cl2=[PtCl2(NH3)4]2++2Cl-. В третьем комплексе все ионы хлора находятся во внешней сфере, и потому в растворе имеется уже пять ионов: [Pt(NH3)6]Cl4=[Pt(NH3)4]4++4Cl-. Наконец, последнее соединение K2[PtCl6], которое ток проводит, но свой хлор «прячет», в растворе существует в виде ионов К+ и [PtCl6]2-.
Очень важно, что Вернер рассмотрел и пространственное строение комплексных соединений. Это позволило ему, в частности, объяснить совершенно непонятные прежде случаи изомерии — когда соединения одинакового состава имеют разные свойства. Так, для комплексов с координационным числом 4 он предложил плоскую квадратную структуру. Лиганды могут располагаться в вершинах квадрата разными способами.

– Конец работы –
Эта тема принадлежит разделу:
Основы Химии
На сайте allrefs.net читайте: "Основы Химии"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: СОЕДИНЕНИЯ В КВАДРАТНЫХ СКОБКАХ. КОМПЛЕКСЫ
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов