рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- При увеличении рН до 8—8,5 окраска фенолфталеина изменяется с бесцветной на малиновую.
Реферат Курсовая Конспект
При увеличении рН до 8—8,5 окраска фенолфталеина изменяется с бесцветной на малиновую.
При увеличении рН до 8—8,5 окраска фенолфталеина изменяется с бесцветной на малиновую. - раздел Химия, Основы Химии Окраске: В Кислой Среде Он Красный, А В Щелочной — Синий. В Наши Дни...
окраске: в кислой среде он красный, а в щелочной — синий.
В наши дни известны несколько сот кислотно-основных индикаторов, искусственно синтезированных начиная с середины XIX в. С некоторыми из них можно познакомиться в школьной химической лаборатории. Индикатор метиловый оранжевый (метилоранж) в кислой среде красный, в нейтральной — оранжевый, а в щелочной — жёлтый. Более яркая цветовая гамма свойственна индикатору тимоловому синему: в кислой среде он малиново-красный, в нейтральной — жёлтый, а в щелочной — синий. Индикатор фенолфталеин (он продаётся в аптеке под названием «пурген») в кислой и нейтральной среде бесцветен, а в щелочной имеет малиновую окраску. Поэтому фенолфталеин используют лишь для определения щелочной среды. В зависимости от кислотности среды изменяет окраску и краситель бриллиантовый зелёный (сто спиртовой раствор используется как дезинфицирующее средство — «зелёнка»). Для того чтобы проверить это, надо приготовить разбавленный раствор бриллиантового зелёного: налить в пробирку несколько миллилитров воды и добавить в неё одну-две капли аптечного препарата. Раствор приобретёт красивый зелёно-голубой цвет. В сильнокислой среде его окраска сменится жёлтой, а в сильнощелочной раствор обесцветится.
Однако наиболее часто в лабораторной практике используется универсальный индикатор — смесь нескольких кислотно-основных индикаторов. Он позволяет легко определить не только


Индикатор тимоловый синий в кислой среде имеет малиново-красную, в нейтральной — жёлтую, а в щелочной — синюю окраску.
характер среды (кислая, нейтральная, щелочная), но и значение кислотности (рН) раствора.
полученную смесь называют магической кислотой.
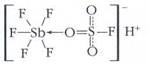
Своим названием данное соединение обязано молодому немецкому химику И. Лукасу, который работал в группе известного химика Георга Ола,
нобелевского лауреата 1994 г, Во время рождественских праздников один из членов группы шутки ради бросил в эту «адскую смесь» восковую свечу, которая немедленно растворилась. «Да это же магическая кислота!» — воскликнул поражённый Лукас. С тех пор термин не только стал общепринятым у химиков, он официально зарегистрирован как торговая марка. Магическая кислота в 1015 раз более «кислая», чем концентрированная серная.
КИСЛОТНОСТЬ СРЕДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
Для характеристики кислотности среды вводят водородный показатель рН, который равен взятому с обратным знаком десятичному логарифму молярной концентрации ионов водорода: pH=-lg[H+].
В зависимости от концентрации ионов Н+ в растворе может быть кислая, нейтральная или щелочная среда. Дистиллированную воду, взятую при температуре 22 °С, принято считать нейтральной. Являясь слабым электролитом, вода частично диссоциирует на ионы Н+ (в водных растворах он всегда гидратирован и присутствует в виде Н3О+) и ОН-. Их концентрации одинаковы и составляют при комнатной температуре 10-7 моль/л.
Несложно рассчитать, что для нейтрального раствора (дистиллированной воды) рН=-lg(10-7)=7. Если значение водородного показателя меньше 7, раствор является кислым, так как концентрация ионов водорода в нём выше концентрации гидроксид-ионов. Например, раствор соляной кислоты с концентрацией 1 моль/л имеет pH=-lg(1)=0.
А при рН больше 7 концентрация ионов водорода в растворе меньше концентрации гидроксид-ионов. Такие растворы называются щелочными. В частности, рН концентрированного раствора гидроксида натрия (10 моль/л) равен 15. Дождевая вода обычно имеет слабокислую реакцию среды (рН=6) за счёт растворения в ней углекислого газа; дождь считается кислотным, если его рН<5. Желудочный сок — это сильнокислая среда (рН=1,7), а рН крови (7,4), слюны (6,9) и слезы (7) близок к нейтральному.
Для определения кислотности среды часто применяют кислотно-основные индикаторы — особые вещества, имеющие в разных средах разную окраску. Как правило, в роли индикаторов выступают слабые органические кислоты или основания, содержащие хромофорные (от греч. «хрома» — «цвет» и «форо» — «несу») группы, которые придают этим веществам яркую окраску. В школьной химической лаборатории в качестве индикаторов обычно используют лакмус, метилоранж и фенолфталеин.

– Конец работы –
Эта тема принадлежит разделу:
Основы Химии
На сайте allrefs.net читайте: "Основы Химии"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: При увеличении рН до 8—8,5 окраска фенолфталеина изменяется с бесцветной на малиновую.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов