рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- При диссоциации кислот происходит разрыв связи О—Н, а при диссоциации оснований — отделение ОН-группы.
Реферат Курсовая Конспект
При диссоциации кислот происходит разрыв связи О—Н, а при диссоциации оснований — отделение ОН-группы.
При диссоциации кислот происходит разрыв связи О—Н, а при диссоциации оснований — отделение ОН-группы. - раздел Химия, Основы Химии ...
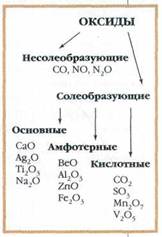
Н3РО4) и бескислородные (соляная кислота НСl, сероводородная кислота H2S).
Основания, или гидроксиды (старые русские их названия — гидроокиси, гидраты окислов), — соединения, содержащие атом металла и одну или несколько гидроксильных групп ОН. Получены основания почти всех металлов периодической системы. Если элемент имеет несколько степеней окисления, ему соответствует несколько оснований, например железу — гидроксид железа(III) Fe(OH)3 и гидроксид железа(II) Fe(OH)2.
Гидроксиды щелочных и щёлочноземельных металлов, хорошо растворимые в воде, называются щелочами. Щёлочи — твёрдые кристаллические вещества, их растворы мылки на ощупь. Гидроксиды щелочных металлов (NaOH, КОН) гигроскопичны, поэтому при хранении в неплотно закрытых склянках они «расплываются».
Нерастворимые в воде основания выделяются из раствора в виде аморфных студенистых осадков, которые со временем кристаллизуются. Часто они имеют переменный состав, поэтому правильнее записывать, например, не Fe(OH)3, a Fe2O3•хН2О. Гидроксиды многих металлов (железа, меди, никеля и др.) ярко окрашены.
Примечательно, что по формуле соединения часто нельзя предсказать,

Гидроксиды алюминия, меди(II) и железа(III). Гидроксид меди(II), образующийся при добавлении раствора щёлочи к раствору сульфата меди: CuSO4+2NaOH=Cu(OH)2¯+Na2SO4, представляет собой студенистый осадок синего цвета. При слабом нагревании он теряет воду, превращаясь в чёрный порошок оксида меди(II): Cu(ОН)2=CuО+Н2О.
*Гигроскопичность (от греч. «гигрос» — «влажный» и «скопео» — «наблюдаю») — свойство веществ или материалов поглощать влагу из воздуха.
Соль есть кислота, в которой водород заменён металлом.
Д. И. Менделеев. «Основы химии»
является ли оно основанием или кислотой: ведь ОН-группы содержатся и в кислотах, и в основаниях. Например, формулу серной кислоты H2SO4 можно записать в виде SO2(OH)2, а борной кислоты Н3ВО3 — как В(ОН)3. В чём
же разница между кислотами и основаниями? Кислоты в растворах диссоциируют с образованием ионов Н+, а основания дают ионы ОН".
Гидроксиды, которые в зависимости от условий проявляют свойства
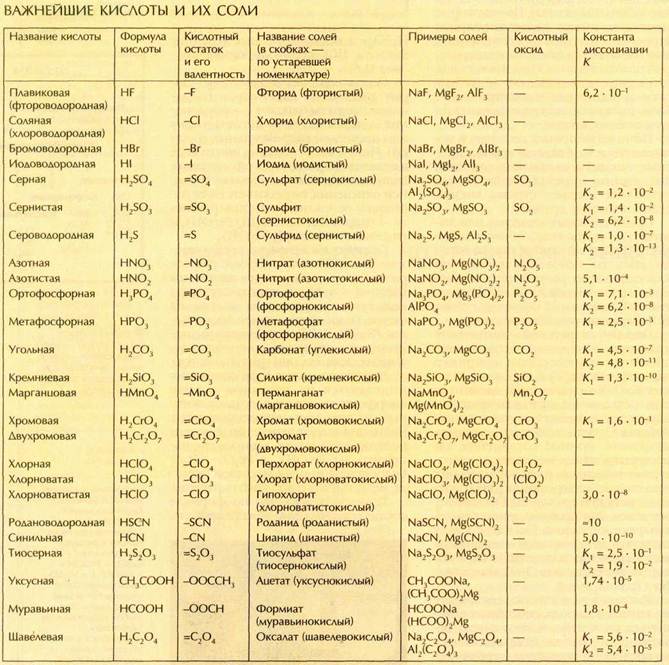
Безводные хлориды многих металлов по свойствам сильно отличаются от соответствующих гидратов. Их получают действием хлора или хлороводорода на металл и хранят в запаянных ампулах. Слева направо: СоСl2, NiCl2, CrCl3, VCl2.

Осаждение сульфата бария: Na2SO4+ВаСl2=BaSO4¯+ 2NaCl.

Порошок малахита (CuОН)2СО3.
то кислоты, то основания, называются амфотерными (от греч. «амфотерос» — «и тот, и другой»).
Соли — это продукты полного или частичного замещения водорода в кислоте на металл или гидроксильной группы в основании на кислотный остаток. Например, если в серной кислоте H2SO4 заместить на калий один атом водорода, получим соль KHSO4, а если два — K2SO4.
Различают несколько типов солей. Кислые соли содержат в своём составе атомы водорода, основные (гидроксосоли) включают ОН-группы. Средние соли ни атомов Н, ни ОН-групп не содержат. Существуют также смешанные (соли двух кислот) и двойные (соли двух металлов). Например, кальцинированная сода Na2CO3 — это средняя соль, питьевая сода NaHCO3 — кислая, а малахит (CuОН)2СО3 — основная, Алюмокалиевые квасцы KAl(SO4)2•12Н2О представляют собой двойную соль, а хлорная известь Са(ОСl)Сl — смешанную.
Однако большая группа неорганических веществ никак не укладывается в рамки перечисленных основных классов. Поэтому кроме оксидов среди бинарных (т. е. состоящих из двух элементов) соединений выделяют гидриды (NaH, NH3), карбиды (СаС2, Fe3C), нитриды (Li3N, Mg3N2) и т. д. Да и сама граница между неорганическими и органическими веществами представляется довольно-таки размытой. Куда отнести, например, такие вещества, как ферроцен Fe(C5H5)2, боразол B3N3H6, карбонил никеля Ni(CO)4? Поэтому классификацию веществ нельзя считать законченной, и не все ветви химического древа получили свои названия.
КИСЛОТЫ И ОСНОВАНИЯ
Сейчас грамотному химику не придёт в голову пробовать на вкус вещества, с которыми он работает, хотя в прошлом вкус являлся обязательной характеристикой при описании каждого соединения. Первоначально под кислотой понимали вещество, раствор которого имеет кислый вкус.
Главные минеральные кислоты — соляная, серная и азотная — были получены ещё алхимиками. Постепенно накапливались факты, свидетельствующие об общих свойствах кислот,
например об их способности разрушать металлы. А. Л. Лавуазье попытался объяснить свойства кислот наличием в них кислорода. Однако кислородная теория кислот сдала свои позиции после того, как был доказан состав соляной кислоты: она кислорода не содержит. В итоге кислородная теория сменилась водородной, которую разработали Г. Дэви и Ю. Либих. Согласно ей, кислотами являются вещества, содержащие атомы водорода, способные замещаться на металл.

– Конец работы –
Эта тема принадлежит разделу:
Основы Химии
На сайте allrefs.net читайте: "Основы Химии"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: При диссоциации кислот происходит разрыв связи О—Н, а при диссоциации оснований — отделение ОН-группы.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов