рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Энергии связи двухатомных молекул в газе (Н. Н. Павлов)
Реферат Курсовая Конспект
Энергии связи двухатомных молекул в газе (Н. Н. Павлов)
Энергии связи двухатомных молекул в газе (Н. Н. Павлов) - раздел Химия, СВОЙСТВА ХИМИЧЕСКОЙ СВЯЗИ Молекула H2 Li2...
| Молекула | H2 | Li2 | Na2 | K2 | F2 | Cl2 | Br2 | I2 | HF | HCl | HBr | HI |
| Есв., кДж/моль | 159 |
В табл. 25 исключением из указанной выше закономерности кажется F2. Дело в том, что у F, в отличие от остальных галогенов, нет d‑АО и отсутствует дативное взаимодействие.
Увеличение полярности (при прочих равных условиях) частоприводит к увеличению энергии связи. Так, для молекулы КСl с ионной связью энергия связи равна 423 кДж/моль, тогда как для неполярных К2 и Сl2 50 и 242 кДж/моль соответственно.
Энергия гетеролитического разрыва связи (на ионы) всегда выше, чем гомолитического (на атомы). Последний процесс (на примере НСl) можно представить как сумму трёх процессов – гомолитической диссоциации (1), отрыва электрона от первого атома (2) и его присоединения ко второму (3):
(1) НСl = Н + Сl + Ед;
(2) Н = Н+ + е + I(Н);
(3) Сl + е = Сl- + Ее(Сl).
Поэтому и энергия гетеролитического разрыва связи равна сумме энергий процессов (1)–(3) (закон Гесса): Е = Ед+ I(Н) + Ее(Сl) = 426 + 1312 - 349 = 1389 кДж/моль, что для НСl примерно в 3 раза больше, чем для гомолитического разрыва.. Самое большое по величине сродство к электрону как раз у хлора (349 кДж/моль); самый малый потенциал ионизации (для Сs) равен 375 кДж/моль. Следовательно, для любой двухатомной молекулы энергия гетеролитического разрыва связи будет больше, чем гомолитического[‡].
При переходе к двухатомным частицам понятие энергии связи теряет однозначность. Например, можно измерить энергии последовательного отрыва атомов водорода от молекулы аммиака:
(1) NH3 = NH2 + H + E1;
(2) NH2 = NH + H + E2;
(3) NH = N + H + E3.
Эти энергии последовательно понижаются: Е1 = 438, Е2 = 384, Е3 = 351 кДж/моль, что в сумме даёт 1197 кДж/моль на три связи. Поскольку все атомы Н в аммиаке эквивалентны, то и связи одинаковы. Логично приписать энергии связи N–Н в молекуле NН3 среднее значение – 399 кДж/моль. Ситуация усложняется, если связи в частице неэквивалентные. Проблему решают так же, как и для ковалентных радиусов: определяют и усредняют значения энергии связи в однотипных соединениях (например, усреднённая энергия связи С–Н в алканах равна 420, С–С‑связи 360 кДж/моль и т. п.). Конечно, энергия связи С–Н, например, в СН3Сl несколько отличается от её энергии в СН4, но эти отличия обычно не очень значительные.
Для кристаллов введено аналогичное энергии связи понятие энергии кристаллической решётки. Это энергия, выделяющаяся при процессе образования кристалла из его структурных составляющих – удалённых на бесконечное расстояние невзаимодействующих атомов (для ковалентных и металлических кристаллов), ионов или молекул для ионных и молекулярных соответственно. Наиболее важен случай ионных решёток. Для них (на примере КCl) энергия решётки – это энергия процесса К+(газ) + Сl(газ) = КСl(крист.) (или энергия, затрачиваемая при обратном процессе).
Как уже обсуждалось в п. 4.1.2, эта энергия для ионных кристаллов сопоставима, а для кристаллов из многозарядных ионов выше типичных энергий ковалентной связи (например, для СаF2, LiF, NaF, KCl и CsI 2610, 1030, 905, 795 и 602 кДж/моль соответственно). Энергия решётки молекулярных кристаллов на 2–3 порядка ниже (15, 10, 1,0, 0,1 кДж/моль для Хе, CH4, H2, Не соответственно). Энергия решётки льда (кристалл с водородными связями) промежуточная – 50 кДж/моль. Энергия решётки металлических кристаллов отличается примерно на порядок – от 78 кДж/моль для самого типичного металла цезия до 500 кДж/моль для ванадия, имеющего промежуточный, ковалентно-металлический характер связи.
 Рассмотрим теперь химическую связь в терминах сил, действующих на связанные частицы (атомы или ионы).
Рассмотрим теперь химическую связь в терминах сил, действующих на связанные частицы (атомы или ионы).
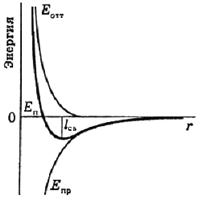
 Для определённости рассмотрим сближение пары разноимёных ионов. Их притяжение описывается законом Кулона (сила Fпр = q1q2/r2, энергия притяжения Епр = -С/r, где q1 и q2 – заряды, С – некоторая константа). При сближении ионов сила и энергия притяжения растут. Однако (при достаточно малых расстояниях) возникает сила отталкивания, складывающаяся из отталкивания электронных оболочек и ядер (рис. 44). Сила отталкивания растёт с уменьшением r сильнее, чем падает сила притяжения (она хорошо аппроксимируется функцией Fотт = С́/rn, где n > 2), поэтому на кривой расстояние – потенциальная энергия существует минимум. Этому минимуму соответствуют равновесная длина связи lcв.[§] по оси r и энергия связи по ординате. За ноль энергии обычно принимают энергию находящихся на бесконечном расстоянии невзаимодействующих частиц, поэтому энергия связи всегда отрицательна.
Для определённости рассмотрим сближение пары разноимёных ионов. Их притяжение описывается законом Кулона (сила Fпр = q1q2/r2, энергия притяжения Епр = -С/r, где q1 и q2 – заряды, С – некоторая константа). При сближении ионов сила и энергия притяжения растут. Однако (при достаточно малых расстояниях) возникает сила отталкивания, складывающаяся из отталкивания электронных оболочек и ядер (рис. 44). Сила отталкивания растёт с уменьшением r сильнее, чем падает сила притяжения (она хорошо аппроксимируется функцией Fотт = С́/rn, где n > 2), поэтому на кривой расстояние – потенциальная энергия существует минимум. Этому минимуму соответствуют равновесная длина связи lcв.[§] по оси r и энергия связи по ординате. За ноль энергии обычно принимают энергию находящихся на бесконечном расстоянии невзаимодействующих частиц, поэтому энергия связи всегда отрицательна.
Качественно вид кривой не меняется и для взаимодействия связанных ковалентной связью атомов, и для вандерваальсового взаимодействия молекул. Конечно, функциональные зависимости сил и энергий притяжения для них другие. Для вандерваальсового взаимодействия хорошо подходит выражение ЕS = Епр + Еотт = –С/r6 + В́/r12 (так называемый потенциал Леннарда–Джонса). К сожалению, и экспериментальное, и особенно расчётное определение вида функциональной зависимости силы (и соответственно энергии) взаимодействия для ковалентной связи представляет пока (в общем) нерешённую задачу.
– Конец работы –
Эта тема принадлежит разделу:
СВОЙСТВА ХИМИЧЕСКОЙ СВЯЗИ
На сайте allrefs.net читайте: "СВОЙСТВА ХИМИЧЕСКОЙ СВЯЗИ"...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Энергии связи двухатомных молекул в газе (Н. Н. Павлов)
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов