рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Эффективные заряды атомов в оксидах (по Н. С. Ахметову)
Реферат Курсовая Конспект
Эффективные заряды атомов в оксидах (по Н. С. Ахметову)
Эффективные заряды атомов в оксидах (по Н. С. Ахметову) - раздел Химия, СВОЙСТВА ХИМИЧЕСКОЙ СВЯЗИ Оксид Na2O Mgo ...
| Оксид | Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
| DЭО | 2,6 | 2,3 | 2,0 | 1,7 | 1,4 | 1,0 | 0,5 |
| dО | 0,81- | 0,42- | 0,31- | 0,23- | 0,13- | 0,06- | 0,01- |
| dЭ | 0,41+ | 0,42+ | 0,47+ | 0,46+ | 0,33+ | 0,18+ | 0,04+ |
| % ионности | 6,5 | 0,3 | |||||
| Темп. плавл., °С | 1728* | -90 |
____________________
* Для одной из кристаллических модификаций.
Даже в оксидах щелочных металлов не существует ионов О2-, эффективный заряд кислорода не превышает 1 (0,9 в самом ионном из оксидов – Сs2О), а степень ионности связи – 50 %. Тем не менее, несмотря на большой ковалентный вклад, оксиды натрия, магния, алюминия (скорее по совокупности других свойств, чем по зарядам атомов – слабой выраженности направленности связи; например, MgO имеет структуру типа NaCl, c КЧ = 6 и др.) классифицируют как ионно-ковалентные.
Хотя, по другим данным (см. Угай Я. Общая химия), эффективный заряд кремния существенно выше и достигает в диоксиде +0,99, совокупность свойств, о которых говорилось в подразд. 4.1, позволяет классифицировать SiO2 как типично ковалентное соединение.
Оксиды серы и хлора – типичные молекулярные соединения, образуют непрочные молекулярные кристаллы (что видно по приведённым низким температурам плавления и кипения). P2O5 имеет промежуточный, ковалентно-молекулярный тип связи.
Если даже для О величина эффективного заряда не превышает 1, то для менее электроотрицательной S в сульфидах она ещё меньше, а ковалентный вклад больше. Исследования эффективных зарядов показывают отсутствие в природе многозарядных одноатомных анионов, о чём уже говорилось выше. Однако, по некоторым данным, многозарядные катионы существуют. По данным учебника Н. С. Ахметова, эффективный заряд хрома в CrCl2 (степень окисления +2) равен +1,9. В то же время в CrCl3 (степень окисления +3) он равен +1,3, а в К2СrО4 (степень окисления +6) только +0,2. Для марганца (VII) в KMnO4 эффективный заряд равен 0,3 (~ 4 % от степени окисления), и т. п.

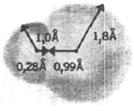 На рис. 43 на примере молекулы НCl в масштабе наглядно представлено распределение электронной плотности. Межатомное расстояние 1,27 Å распределено здесь на ковалентные радиусы как RH = 0,28 и RCl = 0,99 Å. Укорочение межатомного расстояния вследствие образования ковалентной связи (по сравнению с суммой вандерваальсовых радиусов) составляет 1,7 Å – это очень большая величина для мира атомов и молекул. Иначе можно сказать, что электронные оболочки Н и Cl перекрываются на ~1,7 Å – чем больше перекрывание, тем прочнее связь.
На рис. 43 на примере молекулы НCl в масштабе наглядно представлено распределение электронной плотности. Межатомное расстояние 1,27 Å распределено здесь на ковалентные радиусы как RH = 0,28 и RCl = 0,99 Å. Укорочение межатомного расстояния вследствие образования ковалентной связи (по сравнению с суммой вандерваальсовых радиусов) составляет 1,7 Å – это очень большая величина для мира атомов и молекул. Иначе можно сказать, что электронные оболочки Н и Cl перекрываются на ~1,7 Å – чем больше перекрывание, тем прочнее связь.
Можно было бы предположить, что условная граница полусфер электронной плотности, противоположных области связывания, будет расположена на расстояниях, равных вандерваальсовым радиусам атомов, т. е. 1,2 и 1,8 Å. Однако реально эти расстояния несколько (в сумме на 0,2 Å короче) - 1,0 и 1,8 Å для Н и Cl соответственно. Объяснение в том, что эффективные заряды Н и Cl равны +0,2 и -0,2, молекула представляет собой диполь. Вследствие поляризации её размеры сокращаются и радиусы атомов (в «несвязанной» части молекулы) оказываются меньше вандерваальсовых.
– Конец работы –
Эта тема принадлежит разделу:
СВОЙСТВА ХИМИЧЕСКОЙ СВЯЗИ
На сайте allrefs.net читайте: "СВОЙСТВА ХИМИЧЕСКОЙ СВЯЗИ"...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Эффективные заряды атомов в оксидах (по Н. С. Ахметову)
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов