рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Лекция № 4. Кинетика химических реакций.
Реферат Курсовая Конспект
Лекция № 4. Кинетика химических реакций.
Лекция № 4. Кинетика химических реакций. - раздел Химия, Лекция № 4. Кинетика химических реакций На Прошлой Лекции Мы Ввели Критерий Самопроизвольного Протекания Реакций (Dg&...
На прошлой лекции мы ввели критерий самопроизвольного протекания реакций (DG<0), рассмотрели вопрос о принципиальной т.д. возможности или невозможности процесса. Однако, важно и то, насколько быстро будут протекать реакции.
Между значением DG и скоростью нет зависимости (нельзя сказать, что чем больше по абсолютному значению DG, тем быстрее достигается равновесие), так для реакций:
2NO (г) + O2(г) = 2NO2 (г); DG0298= -70 кДж
2H2 (г) +O2(г)=2H2O(г); DG0298 = -447 кДж
Первая реакция протекает очень быстро при комнатной температуре (образование бурого газа), а вторая реакция без катализатора практически не идет.
Если же с т.д. точки зрения реакция невозможна (DG>0), то бессмысленно пытаться реализовать ее в данных условиях.
Исследованием течения реакций во времени занимается химическая кинетика. Она изучает скорости реакций, их зависимость от различных факторов и механизмы реакций.
Механизм реакции – последовательность и характер стадий хим. реакции.
По механизму различают простые и сложные реакции. Простые реакции осуществляются посредством простых элементарных актов. Элементарный акт – единичный акт взаимодействия частиц, в результате которого образуются новые частицы продуктов или промежуточных соединений. В элементарном акте принимает участие одна или две частицы, крайне редко – три.
Для сложных реакций необходимы разнотипные элементарные акты. Сложная реакция – суммарный результат нескольких элементарных процессов. Уравнение реакции в этом случае не отражает механизм реакции. Типы сложных реакций: параллельные (одновременно протекают два или несколько процессов), последовательные (А→В→С), сопряженные(А +В→ М, А+С→N), цепные.
Скорость химической реакции определяется изменением концентрации реагирующих веществ или продуктов реакции в единицу времени. (моль/л с)
Скорость реакции в общем случае не является постоянной в течение всего времени ее протекания. Скорость прямой реакции по мере расходования исходных веществ будет уменьшаться, скорость обратной – увеличиваться. Поэтому используют понятие средней скорости в данном интервале времени Dt:
vср = ±Dc/Dt
Истинная скорость (в любой момент времени) определяется первой производной концентрации по времени:
vср = ±dc/dt
(Рис. Фримантл, I, с. 414, кривая скорости)
Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая

Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
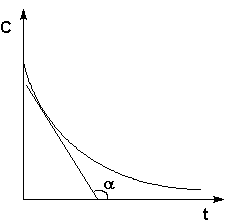
Скорость зависит:
1) от природы реагирующих веществ
– Конец работы –
Эта тема принадлежит разделу:
Лекция № 4. Кинетика химических реакций
Реакции третьего порядка... А В С Е F...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Лекция № 4. Кинетика химических реакций.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов