рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Методы определения порядка реакции и констант скорости из экспериментальных данных.
Реферат Курсовая Конспект
Методы определения порядка реакции и констант скорости из экспериментальных данных.
Методы определения порядка реакции и констант скорости из экспериментальных данных. - раздел Химия, Лекция № 4. Кинетика химических реакций Проведение Реакции В Условиях, Когда Концентрация Одного Из Реагентов Много М...
Проведение реакции в условиях, когда концентрация одного из реагентов много меньше концентрации другого (других) и скорость реакции зависит от концентрации только этого реагента, используется для определения частных порядков реакции – это т.н. метод избыточных концентраций(избытка ) или метод изолирования Оствальда. Порядок реакции по данному веществу определяется одним из перечисленных ниже методов.
Графический метод (линеаризация) (lnc–t; 1/c –t; 1/c2–t)заключается в построении графика зависимости концентрации реагента от времени в различных координатах. Для различных частных порядков эти зависимости имеют следующий вид:
| Порядок реакции | Зависимость концентрации от времени |
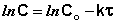
| |
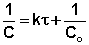
| |
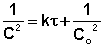
|
Надо найти, в каких координатах график зависимости с=f(t) спрямляется. Если построить графики этих зависимостей на основании опытных данных, то лишь одна из них будет являться прямой линией. Если, например, график, построенный по опытным данным, оказался прямолинейным в координатах lnC = f(t), то частный порядок реакции по данному веществу равен единице.
Метод подстановки – подстановка данных в уравнения 1, 2 и 3 порядков, чтобы k=const. Метод подбора кинетического уравнения заключается в подстановке экспериментальных данных изучения зависимости концентрации вещества от времени в кинетические уравнения различных порядков. Подставляя в приведённые в таблице уравнения значения концентрации реагента в разные моменты времени, вычисляют значения константы скорости. Частный порядок реакции по данному веществу равен порядку того кинетического уравнения, для которого величина константы скорости остаётся постоянной во времени.
| Порядок реакции | Выражение для константы скорости |
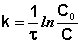
| |

| |
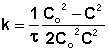
|
Метод определения времени полупревращения заключается в определении t1/2 для нескольких начальных концентраций. Как видно из приведённых в таблице уравнений, для реакции первого порядка время полупревращения не зависит от Co, для реакции второго порядка – обратно пропорционально Co, и для реакции третьего порядка – обратно пропорционально квадрату начальной концентрации.
| Порядок реакции | Выражение для периода полупревращения |
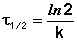
| |
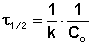
| |
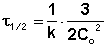
|
По характеру зависимости t1/2 от Co нетрудно сделать вывод о порядке реакции по данному веществу. Дать рисунки с(t) из Фримантла. Данный метод, в отличие от описанных выше, применим и для определения дробных порядков.
– Конец работы –
Эта тема принадлежит разделу:
Лекция № 4. Кинетика химических реакций
Реакции третьего порядка... А В С Е F...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Методы определения порядка реакции и констант скорости из экспериментальных данных.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов