рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Реакции нуклеофильного замещения
Реферат Курсовая Конспект
Реакции нуклеофильного замещения
Реакции нуклеофильного замещения - раздел Химия, ОКСИПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ 3.1 Алкилирование Гидросульфата: ...
3.1 Алкилирование гидросульфата:
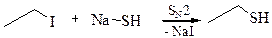
3.2 Алкилирование сероводорода:
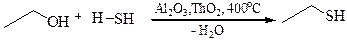
3.3 Получение тиоэфиров:
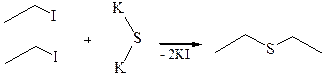
4. Взаимодействие алкилгалогенидов с ксантогенатами щелочных металлов (Л.А. Чугаев):
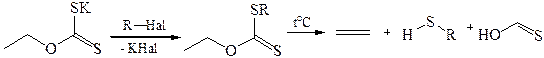
5. Промышленные методы. В промышленности низшие тиолы получают взаимодействием спиртов с H2S в присутствии катализаторов при 300–350 °С. Третичные алкантиолы C8 – C16 – взаимодействием непредельных углеводородов с H2S в присутствии А12О3 при 100–135 °С и давлении 3,5–7 МПа.
Физические свойства и строение. Тиолы представляют собой бесцветные соединения с чрезвычайно неприятным запахом, которым обнаруживается уже в ничтожных концентрациях. Алкантиолы содержатся в кишечных газах человека и животных, в зловонных выделениях некоторых животных.
Атом S в меркаптогруппе имеет гибридизацию, промежуточную между sp2 и sp3. Например, для молекулы СН3SН:
· длины связей С–S 0,1817 нм, S–H 0,1329 нм;
· валентный угол CSH = 96,5°;
· энергия связи S–H 360 кДж/моль.
Потенциал ионизации для CH3SH – 9,44 эВ с удлинением углеродной цепи понижается. Электронная система атома серы значительно подвижнее, чем кислоррода, что отражается и на энергии ионизации. Тиолы являются более сильными электронодонорами. В молекулах тиолов угол CSH равен 100–104°, что меньше, чем угол СОН в алканолах. Для тиолов характерна линейная зависимость термодинамических величин от молекулярной массы (таблица 17).
Таблица 17 – Энергия диссоциации связи С–SH в тиолах
| Соединение | Eдис., кДж/моль |
| CH3SH | 293,3 |
| C2H5SH | 289,1 |
| C3H7SH | 284,9 |
| C4H9SH | 272,35 |
Группа SH обладает слабым – I и +M эффектами, кислотные свойства ее выше, а основные ниже, чем группы ОН. Связь S–Н менее полярна, чем связь О–Н, поэтому у тиолов слабее межмолекулярные водородные связи и ниже температуры кипения, чем у соответствующих кислородных аналогов (таблица 18).
Таблица 18 – Физические свойства некоторых тиолов
| Соединение | Мr | Тпл., °С | Ткип., °С | d420 | nD20 |
| Метантиол | 48.11 | –123,02 | 6,02 | 0,8665 | – |
| Этантиол | 62,13 | –144,40 | 35,00 | 0,8391 | 1,4310 |
| Пропантиол | 76.16 | –113,30 | 67,60 | 0,8411 | 1,4380 |
| 2-Пропантиол | 76,16 | –130,54 | 52,56 | 0,8143 | 1.4255 |
| Бутантиол | 90,19 | –116,00 | 98,58 | 0,8416 | 1,4429 |
| 2-Метилпропантиол | 90,19 | –140,20 | 85,15 | 0,8295 | 1,4366 |
| Пентантиол | 104,22 | –75,70 | 126,64 | 0,8421 | 1,4469 |
| Циклогексантиол | 116,17 | – | 158,0 | 0,9782 | 1,4921 |
| Октантиол | 146,29 | –49,20 | 77–78 | 0,8433 | 1,4540 |
| 2-Метил-2-пропантиол | 90,19 | 1,11 | 64,22 | 0.8002 | 1,4332 |
В разбавленных растворах тиолы существуют в виде мономеров, а в более концентрированных – в виде димеров преимущественно линейного строения благодаря образованию водородных связей S–H...S. В жидком и твердом состоянии тиолы могут образовывать полимеры.
– Конец работы –
Эта тема принадлежит разделу:
ОКСИПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
На сайте allrefs.net читайте: ОКСИПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ.
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Реакции нуклеофильного замещения
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов