рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Взаимодействие тиолов с нитрилами, альдегидами и кетонами
Реферат Курсовая Конспект
Взаимодействие тиолов с нитрилами, альдегидами и кетонами
Взаимодействие тиолов с нитрилами, альдегидами и кетонами - раздел Химия, ОКСИПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ Взаимодействие Тиолов С Нитрилами В Кислых Средах Приводит К Иминотиоэфирам, ...
Взаимодействие тиолов с нитрилами в кислых средах приводит к иминотиоэфирам, например:
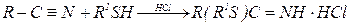
При действии тиолов на альдегиды или кетоны в присутствии кислых катализаторов образуются соответствующие тиоацетали или тиокетали:
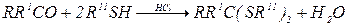
3. Окисление. Тиолы легко окисляются. При действии О2 в щелочной среде, йода, o-йодбензойной кислоты, алифатических сульфоксидов, активированными МnО2, Н2О2, образуются дисульфиды RSSR (в присутствии металлов – Сu, Со, Ni), реакция протекает по радикальному механизму:
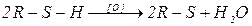
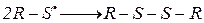
(СН3СОО)4Рb в спирте окисляет тиолы до сульфинатов RSOOCH3, галогены в водной среде – до сульфонилгалогенидов RSO2Hal, более жесткие окислители (Н2О2) – до сульфокислот RSO3H.
Окисление тиолов происходит иначе, чем окисление спиртов, вследствие того, что сера окисляется намного легче, чем углерод. Соединения, в которых сера находится в относительно более высоком окислительном состоянии, часто оказываются весьма устойчивыми. Кроме того, поскольку прочность связи S–Н (83 ккал) значительно меньше, чем прочность связи О–Н (111 ккал), можно с большим основанием ожидать, что механизмы реакции, не осуществляющиеся в случае спиртов, вполне могут оказаться более выгодными в случае серы. Действительно, окисление тиолов при действии широкого ряда мягких окислительных агентов, например, кислорода воздуха, галогенов, серной кислоты и т. д., дает дисульфиды, вероятно, через промежуточное образование тиокси-радикалов; возможно также, что в некоторых случаях окисление проходит через производные сульфеновой кислоты:
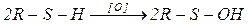

Энергичное окисление тиолов азотной кислотой, перманганатом или перекисью водорода приводит к сульфокислотам, возможно, через промежуточное образование дисульфида.
Другая возможность заключается в промежуточном образовании сульфеновых или сульфиновых кислот, которые окисляются слишком легко для того, чтобы их можно было выделить:
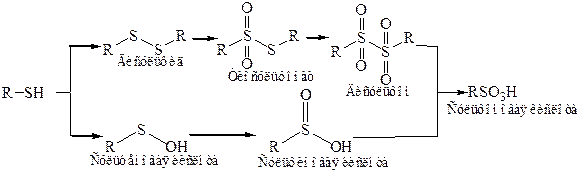
Сульфооксиды обладают слабыми основными свойствами и образуют соли с сильными кислотами. Сульфоны нейтральны и химически инертны.
4. Образование дисульфидов и их роль в биохимических процессах. В зависимости от условий окисления тиолы превращаются в различные серусодержащие соединения. При мягком окислении (Н2О2) тиолы очень легко превращаются в дисульфиды. Дисульфидами называются соединения, содержащие в молекуле группировку из двух атомов серы –S–S–. Общая формула дисульфидов R–S–S–R:
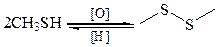
Серосодержащие соединения ширко предствлены в природе и нередко выполняют важные функции. Огромное биологичское значение имеет легкость и обратимость взаимопревращения сульфгидридных и дисульфидных групп:
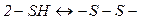
5. Восстановление дисульфидов. Дисульфиды легко восстанавливаются в тиолы. Процесс окисления тиолов и восстановления дисульфидов играет важную роль в химии белков и пептидов:
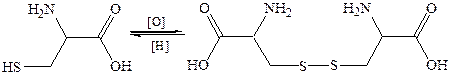
Тиолом является одна из важных серосодержащих аминокислот – цистеин, входящая в состав белков и образующая при мягком окислении свой дисульфидный аналог – цистин. В белковой молекуле дисульфидные связи играют роль своебразных «застежек»-мостиков, скрепляющих отдельные фрагменты полипептидной цепи, вследствие чего возникает определенная конфигурация цепи, необходимая для выполнения белком своих функций.
– Конец работы –
Эта тема принадлежит разделу:
ОКСИПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
На сайте allrefs.net читайте: ОКСИПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ.
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Взаимодействие тиолов с нитрилами, альдегидами и кетонами
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов