рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Проміжний обмін нуклеїнових кислот
Реферат Курсовая Конспект
Проміжний обмін нуклеїнових кислот
Проміжний обмін нуклеїнових кислот - раздел Химия, З історії розвитку біохімії Біосинтез Нуклеїнових Кислот Матеріалом Для Синтезу Нуклеїнов...
Біосинтез нуклеїнових кислот
Матеріалом для синтезу нуклеїнових кислот у клітинах можуть бути екзогенні продукти гідролітичного розщеплення ДНК і РНК їжі. Частину матеріалів для цих процесів клітини одержують у вигляді продуктів вуглеводного, ліпідного і білкового обміну. З трьох складових частин нуклеотидів – пуринових і піримідинових основ, пентоз і фосфатів – дві останніх завжди є в клітині як продукти проміжного обміну. Пуринові і піримідинові основи клітина одержує в результаті всмоктування поживних речовин або біосинтезу з більш простих сполук.
Біосинтез пуринових нуклеотидів. Використання мічених атомів (15N і 13C) показало, що в утворенні пуринового ядра бере участь ряд речовин. Так, два атоми азоту пуринового ядра походять від амідної групи глутаміна, по одному атому азоту – від гліцина і аспарагінової кислоти, атоми вуглецю – від форміата, гліцина і вуглекислого газу (рис.2).
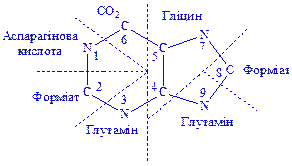
Рис. 2. Походження атомів пуринового ядра
Біосинтез пуринових нуклеотидів відбувається поетапно.
1. Рибозо-5-фосфат під впливом ферменту рибозофосфат-пірофосфокінази взаємодіє з АТФ, що призводить до утворення a-5-фосфорибозил-1-пірофосфата (ФРПФ):
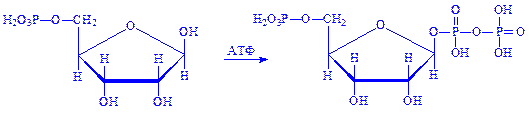
2. ФРПФ під впливом ферменту амідофосфорибозил-трансферази амінується за рахунок глутаміна, утворюючи b-5-фосфорибозил-1-амін:

3. b-5-фосфорибозил-1-амін під впливом ферменту фосфорибозилгліцинамід-синтетази вступає в реакцію з гліцином, утворюючи гліцинамідрибонуклеотид:

4. Гліцинамідрибонуклеотид за участю ферменту фосфорибозилгліцинамід-форміл-трансферази вступає в реакцію з N5, Н10-метилентетрагідрофолієвою кислотою, утворюючи N-форміл-гліцинамід-рибонуклеотид:

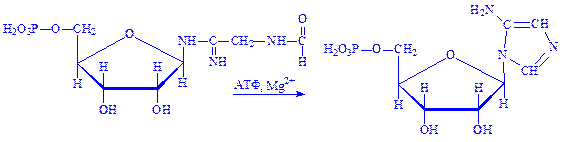
5. Далі під впливом ферменту фосфорибозилформіл-гліцинамідинсинтетази, речовина, що утворилася вступає в реакцію з глутаміном і перетворюється на формілгліцинамідин-рибонуклеопротеїд (форміл-ГАМ):

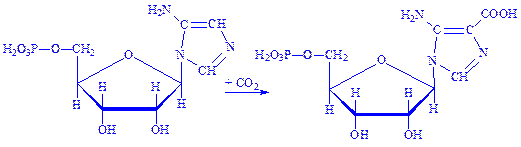
6. Форміл-ГАМ взаємодіє з АТФ під впливом ферменту фосфорибозиламіноімідазол-синтетази у присутності іонів Mg2+. Відбувається замикання кільця, що призводить до утворення 5-аміноімідазолрибонуклеотида:
7. Останній під впливом фосфорибозиламіноімідазол-карбоксилази карбоксилюється і перетворюється на рибонуклеотид 5-аміноімідазол-4-карбонової кислоти:
8. Сполука, яка утворилася, за участю ферменту 5-аміноімідазолсукцинокарбоксамід-синтетази і АТФ, взаємодіє з аспарагіновою кислотою:
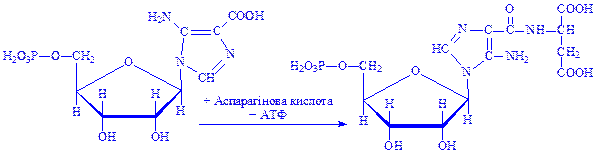
9. 5-Аміноімідазол-4-N-сукцинокарбоксамід-рибонуклеотид реагує під впливом ферменту фосфорибозилгліцинамід-формілтрансферази з N10-формілтетрагідрофолієвою кислотою:
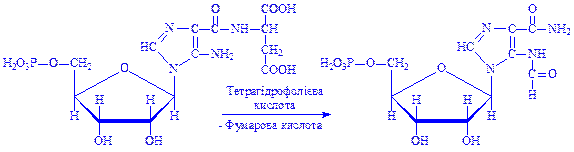
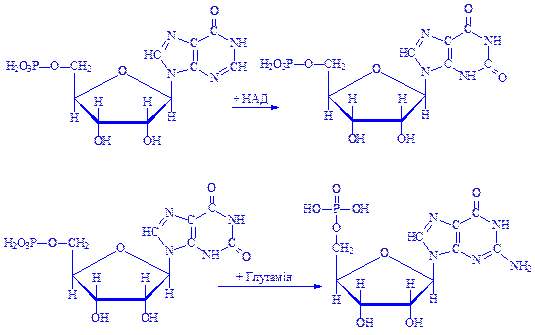
10. 5-Формамідімідазол-4-карбоксамідрибонуклеотид під впливом ферменту ІМФ-циклогідролази втрачає молекулу води, циклізується і перетворюється на інозинову кислоту – попередник аденілової і гуанілової кислот:
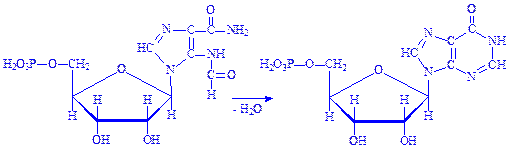
Далі інозинова кислота під впливом ферменту 5-аміноімідазол-сукцинокарбоксамід-синтетази взаємодіє з аспарагіновою кислотою з утворенням аденілоянтарної кислоти, молекула якої надалі розпадається на аденілову і фумарову кислоти. Донором енергії є ГТФ:
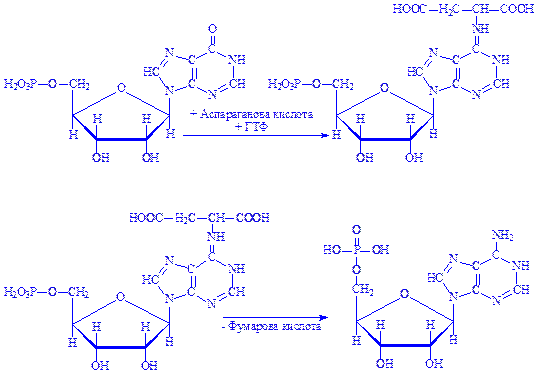
При утворенні молекули гуанілової кислоти інозинова кислота окислюється до ксантозин-5'-фосфата, який після взаємодії з глутаміном перетворюється на гуанілову кислоту:
Для біосинтезу полінуклеотидів потрібні макроергічні зв'язки. Вони утворюються за рахунок АТФ або іншого донатора енергії. Реакція протікає в дві стадії під впливом ферментів нуклеозидмонофосфат- і нуклеозиддифосфаткіназ:
ГМФ + АТФ ® ГДФ + АДФ;
ГДФ + АТФ ® ГТФ + АДФ.
Біосинтез піримідинових нуклеотидів. Початковою речовиною для синтезу піримідинових нуклеотидів є уридин-5'-монофосфат, який синтезується з урацила, пентози і фосфату. Пентози і фосфат завжди є в клітинах і міжклітинній рідині. Піримідинове кільце виникає з амінокислот, вуглекислого газу і форміата. Використання мічених атомів показало, що головним постачальником азоту є аспарагінова кислота і глутамін, вуглецю – CO2 і форміат.
Процес утворення нуклеотидів протікає поетапно.
1. Спочатку під впливом ферменту карбамоїлфосфатсинтази за наявності NH3 і CO2 енергії АТФ утворюється карбамоїл фосфат:

2. Під впливом ферменту аспартат-карбамоїлтрансферази карбамоїл фосфат взаємодіє з аспарагіновою кислотою, що призводить до утворення карбамоїласпартата:
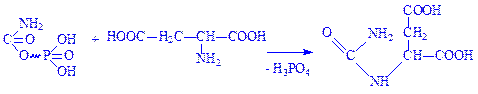
3. У результаті взаємодії аміногрупи карбамоїласпартата з карбоксильною групою виникає циклічна сполука – дигідрооротова кислота, яка під впливом ферменту дегідрогенази перетворюється на оротову кислоту:
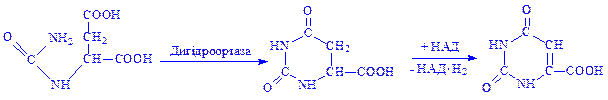
4. Під впливом оротидин-5'-фосфат-пірофосфорилази оротова кислота вступає в реакцію з 5-фосфорибозил-1-пірофосфатом, утворюючи оротидин-5-фосфат, який декарбоксилується і перетворюється на уридин-5'-фосфат:

5. Уридин-5'-фосфат – попередник інших піримідинових нуклеотидів. Для цього УМФ під впливом кіназ за рахунок АТФ перетворюється в УДФ і УТФ:
УМФ + АТФ ® УДФ + АДФ;
УДФ + АТФ ® УТФ + АДФ.
6. Перетворення урацила в цитозин відбувається на рівні нуклеозидтрифосфатів під впливом ЦТФ-синтетази:
УТФ + NH3 + АТФ ® ЦТФ + АДФ + Фн
де Фн – фосфат неорганічний.
7. Перетворення урацила в тимін відбувається внаслідок реакції метилювання з S-аденозилметіоніном (CH3–R) утворюється ТТФ:
УТФ + CH3–R + АТФ ® ТТФ + АДФ + Фн + R
Перетворення піримідинових і пуринових рибонуклеотидів у дезоксирибонуклеотиди відбувається в результаті реакції відновлення, наприклад:
ТТФ  дТТФ.
дТТФ.
Матричний синтез нуклеїнових кислот. Біосинтез ДНК відбувається під час інтерфази мітотичного поділу клітини. ДНК концентрується в хромосомах і хроматині.
Синтез ДНК. Оскільки у молекулах ДНК закодована вся генетична інформація організму, синтез і відтворення їх є необхідним і життєво-важливим процесом.
Процес синтезу ДНК називається реплікацією (копіювання, самоподвоєння), оскільки передача інформації відбувається в межах одного виду нуклеїнових кислот (від ДНК до ДНК). Реплікація відбувається у процесі росту і нормального поділу ДНК-вмісних структур (ядер, мітохондрій, пластид в еукаріот), а також у процесі поділу бактеріальних клітин та під час розмноження вірусів.
Гіпотезу щодо механізму реплікації запропонували Д. Уотсон і Ф. Крік після того, як було встановлено, що молекула ДНК складається з двох взаємокомплементарних полінуклеотидних ланцюгів. Суть даного механізму полягає в тому, що синтез ДНК здійснюється на одноланцюговій матриці, роль якої виконує ланцюг молекули ДНК, що реплікується. Подвійна спіраль ДНК при цьому розкручується і на кожному з ланцюгів добудовується новий комплементарний ланцюг (утворюється репліка).
Пізніше було встановлено, що для ДНК характерним є напівконсервативний механізм реплікації (від англ. conserve – зберігати) – у кожній новій синтезованій молекулі один ланцюг „старий”, одержаний з вихідної материнської ДНК, а другий – „новий”, синтезований (дочірній), тобто реплікація проходить так, що два ланцюги – вихідний і реплікований, сполучаючись між собою, утворюють наступне покоління молекул ДНК. Внаслідок цього процесу з однієї вихідної молекули ДНК утворюються дві молекули – точні копії, репліки, абсолютно ідентичні одна одній і вихідній матричній молекулі ДНК (рис. 3).
Як якісний, так і кількісний вміст залишків нуклеотидів у полінуклеотидних ланцюгах материнської і дочірніх ДНК повністю співпадає. Напівконсервативний механізм синтезу ДНК відіграє важливу роль у забезпеченні видоспецифічної передачі генетичної інформації від покоління до покоління і є запорукою збереження сталості видів організмів.
Згідно з дослідженнями А. Корнберга, вихідними сполуками для синтезу ДНК є вільні дезоксирибонуклеозид-5-трифосфати азотистих основ (аденіну, гуаніну, цитозину, тиміну), які під впливом відповідних ферментів сполучаються між собою з утворенням полінуклеотидних ланцюгів. Загальну схему синтезу ДНК можна подати так:

Реплікація ДНК – багатоступінчастий процес, для здійснення якого необхідні певні умови і наявність чотирьох видів рибо- і дезоксирибонуклеозид-5-трифосфатів, матриці у вигляді дволанцюгової ДНК, ферментів і білкових речовин, затравки (праймера), іонів (Mg2+, Mn2+).

Рис. 10. Схема реплікації ДНК
Матрицею служить молекула ДНК, яка реплікується. Разом з дим для здійснення реплікації необхідно близько 20 реплікативних факторів, що називаються ДНК-репліказною системою, або репліосомою. Важливими компонентами ДНК-репліказної системи є ферменти синтезу ДНК. У процесі реплікації беруть участь ферменти ДНК-залежні ДНК-полімерази (І, II, ІІІ) РНК-полімерази, ДНК-ліази, екзонуклеази, ДНК-лігази. Кожен з цих ферментів забезпечує здійснення певних етапів синтезу ДНК і часто виявляє кілька видів ферментативної активності. Зокрема, вважають, що ДНК-полімераза III, яка відіграє головну роль у процесі реплікації, має 5' ® 3' полімеразну і 3' ® 5' екзонуклеазну активності, ДНК-полімераза І має три види ферментативної активності: 5¢ ® 3' полімеразну, 3' ® 5' екзонуклеазну і 5' ® 3' екзонуклеазну. Цей фермент забезпечує розщеплення PHK затравки на матриці ДНК та процеси репарації пошкоджених ділянок молекули. ДНК-полімераза II за властивостями подібна до ДНК-полімерази І, однак для неї не характерна 5' ® 3' екзонуклеазна активність. Функції цього ферменту в клітині вивчені не достатньо. РНК-полімераза забезпечує синтез затравного ланцюга PHK (праймера) на ДНК-матриці.
Важливими компонентами ДНК-репліказної системи є також білкові речовини, які забезпечують протікання ряду необхідних етапів синтезу ДНК, зокрема таких, як:
1) „впізнавання” місця початку реплікації ДНК ферментами ДНК-полімеразами;
2) локальне розкручування дуплексу ДНК і вивільнення одноланцюгових матриць;
3) стабілізація утвореної структури;
4) синтез затравних ланцюгів (праймерів) для ініціації ДНК-полімерази III;
5) переміщення реплікативної вилки в ході копіювання;
6) закінчення синтезу та утворення нативної конформації молекули ДНК.
Ці процеси забезпечуються ДНК-зв’язуючими білками (ДЗБ), ДНК-розкручуючими білками (хеліказами), ДНК-стабілізуючими білками (гіразами) тощо.
Слід зазначити, що реплікація ДНК має певні особливості, зокрема, напівконсервативний механізм, одночасність синтезу обох ланцюгів, двонапрямленість реплікації, синтез дочірніх ланцюгів у напрямку 5' ® 3¢ , наявність праймера з вільною 3' –ОН групою дезоксирибози, фрагментарний характер реплікації.
Процес реплікації ДНК включає три взаємозалежні і взаємозв'язані етапи: ініціацію, елонгацію і термінацію.
Ініціація. Цей етап синтезу ДНК об'єднує процеси, які забезпечують початок синтезу полінуклеотидного ланцюга. Суть їх полягає у формуванні реплікативної вилки та синтезі праймера.
Оскільки для забезпечення напівконсервативного механізму синтезу ДНК необхідна наявність одноланцюгової матриці, важливою умовою початку реплікації є дестабілізація трьохмірної структури ДНК та розкручування її подвійної спіралі з утворенням реплікативної вилки (рис. 4).
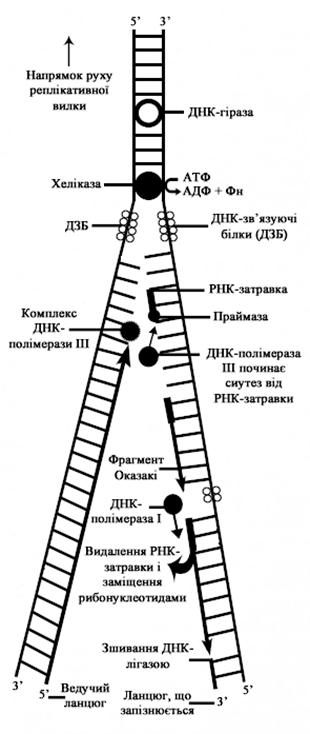
Рис. 4. Реплікативна вилка
В еукаріот, на відміну від прокаріот, утворюється багато стартових точок реплікації – від 10 до 100 тисяч. Кожна з них розміщується в окремих ділянках полінуклеотидного ланцюга, і реплікація їх проходить незалежно. Такі самостійні одиниці реплікації називаються репліконами. У бактерій роль реплікону виконує хромосома.
Отже, в еукаріот молекула ДНК – це полірепліконна система, що містить велику кількість репліконів, з середини яких у двох напрямках рухаються реплікативні вилки.
ДНК при утворенні реплікативної вилки розкручується не по всій довжині, а невеликими ділянками – відрізками, що містять до 2 тисяч неспарепих основ. Утворення реплікативної вилки забезпечується білковими речовинами, які визначають точку старту реплікації та зумовлюють розкручування подвійної спіралі ДНК. У клітинах еукаріот ці процеси забезпечуються комплексною дією ДНК-розкручуючих білків. Так, топоізомерази руйнують суперспіралізовану структуру ДНК хроматину, свівелази або релаксуючі білки, зумовлюють розрив одного з ланцюгів ДНК, внаслідок чого стає можливим розкручування двоспіральної структури ДНК за участю хеліказ.
У результаті поетапної дії вищезазначених факторів двоспіральна молекула ДНК розкручується й утворюється дві одноланцюгові матриці. Оскільки в двоспіральній молекулі ДНК ланцюги антипаралельні – один з них має напрямок 5¢ ® 3', а інший – 3' ® 5', то після розкручування дуплексу утворюються одноланцюгові антипаралельні матриці. В зв'язку з тим, що реплікація за участю ДНК-полімерази III може проходити лише в напрямку 5' ® 3¢ напрямок реплікації одного ланцюга співпадає з напрямком реплікативної вилки, цей ланцюг називається ведучим, а ланцюг, реплікація якого протилежна напрямку реплікативної вилки, – тим, що запізнюється, другорядним.
Після розкручування подвійної спіралі та утворення реплікативної вилки наступає друга стадія ініціації – синтез праймера, або затравного ланцюга, PHK на структурі ДНК-матриці. Необхідність цього процесу зумовлена тим, що ДНК-полімераза III не здатна самостійно розпочати синтез ДНК на структурі матриці з використанням вільних нуклеозидтрифосфатів. Тому для ініціації синтезу ДНК необхідна затравка, яка б містила вільну 3'–ОН групу, за якою може здійснюватись ДНК-полімеразна ІІI реакція. Встановлено, що функцію затравки виконують невеликі олігонуклеотидні фрагменти PHK, комплементарні ДНК-матриці. Затравка в середньому містить 8 – 10 нуклеотидів. Синтез затравного полінуклеотидного ланцюга каталізує мультиферментний комплекс, так звана „праймосома”. До складу праймосоми входять ферменти – специфічна ДНК-залежна РНК-полімераза (ДНК-праймаза), ДНК-залежна АТФ-аза, а також білкові фактори: ДНК-зв'язуючий білок (білок В), білок n¢ тощо. ДНК-зв'язуючий білок визначає місце старту, з якого праймаза розпочинатиме синтез затравного ланцюга в напрямку 5' ® 3'. Праймосома рухається по ланцюгах матриці і синтезує праймер. Цей процес розпочинається із приєднання до стартової точки ведучого полінуклеотидного ланцюга матриці ДНК-зв¢язуючого білка. Далі за участю праймази проходить синтез затравкого ланцюга PHK, комплементарного матриці ДНК. Після закінчення синтезу на ведучому ланцюгу праймосома переміщується на ланцюг, що запізнюється, й ініціює синтез праймера на ньому. По ланцюгу ДНК, що запізнюється, праймосома рухається до наступного місця ініціації в напрямку, протилежному напрямку синтезу ДНК, але однонапрямленому з реплікативною вилкою, синтезує затравку і знову переміщується вперед. Враховуючи це, білок В називають мобільним промотором реплікації. Енергія для руху праймосоми забезпечується завдяки активності АТФ-аз білка n'.
Отже, в результаті дії праймосоми синтезується РНК-затравка на структурі ДНК-матриці. На 3'–ОН кінці затравки замість праймосоми приєднується ДНК-залежна ДНК-полімераза III, яка використовує 3¢–ОН групу для продовження копіювання матричної молекули ДНК. Синтезом праймерів завершується процес ініціації.
Елонгація, або подовження полінуклеотидного ланцюга, включає два процеси: реплікацію ділянок материнської ДНК і сполучення синтезованих ділянок між собою. Ці процеси забезпечуються ДНК-полімеразою III, яка виявляє полімеразну та нуклеотидилтрансферазну активність. Отже, в цьому випадку ДНК-полімераза III діє на два субстрати: на спарений з матрицею кінець затравки, яка містить вільну 3'–ОН групу рибози, і на дезоксирибонуклеозид-5-трифосфати (дРТФ). Хімізм реакції поліконденсації полягає в нуклеофільній атаці a-атома фосфату дРТФ 3'–ОН групою, яка міститься на кінці затравки. В результаті реакції дезоксирибокуклеозид-5-монофосфат приєднується за місцем атома водню гідроксильної групи з утворенням 3' ® 5'-фосфодіефірного зв'язку і вивільненням пірофосфату. Продукт реакції містить вільну 3'–ОН групу, за якою знову повторюється аналогічна реакція, що дістала назву „ріст з хвоста”.
В результаті багаторазового повторення цієї реакції здійснюється поступовий ріст нового полінуклеотидного ланцюга, комплементарного матричному ланцюгу ДНК.
Дослідженнями, японський вчений Оказакі в 1968 р., встановив, що синтез полінуклеотидів ДНК на матричній ДНК проходить не безперервно, а окремими фрагментами, які дістали назву фрагментів Оказакі. Утворюються вони внаслідок приєднання до 3'–ОН групи праймерів 1000 – 2000 дезоксирибонуклеотидних залишків. Послідовність нуклеотидів синтезованих фрагментів комплементарна нуклеотидній послідовності відповідної ділянки ланцюга матриці. Поступове нарощування фрагментів Оказакі триває доти, поки не досягне місця, де розташована нова затравка, з якої розпочинається ріст нового фрагменту полінуклеотидного ланцюга.
Тепер вважають, що фрагментарний механізм реплікації властивий в основному полінуклеотидному ланцюгу, що запізнюється. Вважають, що для ведучого ланцюга фрагментація не характерна.
За даними Оказакі, в живих клітинах має місце човниковий механізм реплікації. Суть його полягає в тому, що спочатку реплікація відбувається в напрямку 5' ® 3' під час просування вперед по одному ланцюгу, а потім у напрямку 5' ® 3' продовжується в протилежному напрямку по другому полінуклеотидному ланцюгу матричної ДНК. Інакше кажучи, один полінуклеотидний ланцюг синтезується в напрямку реплікативної вилки, а інший – у протилежному.
Синтезовані фрагменти Оказакі на 5'-кінці дезоксирибози містять ковалентно зв'язану РНК-затравку. Остання за участю ДНК-полімерази І, яка виявляє ендонуклеазну активність, видаляється. В міру видалення рибонуклеозидних мономерів праймера проходить їх заміна на комплементарні дезоксирибонуклеозидмонофосфати. Здійснюється цей процес за участю ДНК-полімерази І. Далі фрагменти Оказакі під каталітичним впливом ферменту лігази сполучаються між собою й утворюють дочірній ланцюг ДНК. Два новосинтезованих ланцюги, сполучаючись із своїми комплементарними матрицями, утворюють дві дочірні молекули ДНК, кожна з яких містить один материнський і один дочірній ланцюги.
Термінація. Механізм термінації, або завершення синтезу ДНК, вивчено недостатньо. В геномі деяких бактерій термінацію здійснює спеціальний термінатор, в інших такий термінатор відсутній. Тому припускають, що реплікація завершується після зустрічі двох реплікативних вилок, які рухаються назустріч одна одній.
Процес реплікації проходить з досить високою швидкістю: 1000 – 2000 нуклеотидів за секунду у прокаріот і близько 100 нуклеотидів у еукаріот. Для цього процесу характерна велика точність. Так, у процесі реплікації на 1010 пар нуклеотидів трапляється лише одна помилка. Помилково включений нуклеотид (наприклад, урацил замість тиміну) миттєво видаляються із синтезованого полінуклеотидного ланцюга, і на його місце вводиться новий. Забезпечення точності реплікації є одним з важливих етапів передачі спадкової інформації від одного покоління до іншого.
Синтез PHK на матриці PHK. Учений М.C. Гершенсон і американський біохімік Г. Тимін встановили, що крім реплікації існує й інший шлях синтезу ДНК, коли матрицею служить молекула PHK.
Оскільки передача генетичної інформації між різними видами нуклеїнових кислот (ДНК ® PHK) називається транскрипцією (переписування), то процес, що протікає у протилежному напрямку (PHK ® ДНК), дістав назву зворотної транскрипції. Каталізує процес фермент РНК-залежна ДНК-полімераза, або ревертаза (зворотна транскриптаза). Цей фермент було виділено в 1969 – 1970 pp. із тканин, інфікованих онкогенними вірусами, а також із самих вірусів цієї групи, зокрема вірусу Раушера лейкемії мишей і вірусу саркоми Рауса. Ревертаза активується іонами Mn2+, Mg2+, причому першими ефективніше, ніж другими.
Вивчення будови ферменту, виділеного із вірусів мієлобластозу птахів, показало, що він складається з двох білкових субодиниць з молекулярною масою 110 000 і 70 000 і містить два атоми зв'язаного цинку. Для функціонування ферменту ревертази необхідна затравка і матричний ланцюг PHK. Спочатку на одноланцюговій РНК-матриці за участю ферменту ревертази синтезується одноланцюгова ДНК. Внаслідок цього утворюється гібридна PHK – ДНК молекула, яка далі виконує роль матриці для синтезу комплементарного полінуклеотидного ланцюга ДНК. Цей етап каталізує фермент РНК-залежна ДНК-полімераза. На останньому етапі за участю ферменту РНК-ази від PHK відщеплюється молекула ДНК. Далі така ДНК включається в геном інфікованої, клітини і зумовлює переродження її в ракову. Однак зворотну транскриптазу виявлено і в культурах синцитіальних вірусів, які не викликають злоякісного переродження клітин. За певних умов здатність каталізувати синтез ДНК на PHK виявляють і ДНК-полімераза І та еукаріотичні ДНК-полімерази.
Відкриття процесу зворотної транскрипції має важливе теоретичне і практичне значення. Якщо раніше вважалось, що передача генетичної інформації в усіх організмів, за винятком РНК-вмісних вірусів, проходить лише від ДНК до ДНК і від ДНК до PHK, то нині встановлено, що вона може здійснюватись і від PHK до ДНК. Виявлення ферменту ревертази має важливе значення для ранньої діагностики онкологічних захворювань. Ревертаза становить значний інтерес і для генної інженерії (синтез окремих генів).
Біосинтез PHK на матриці ДНК. На матриці ДНК синтезується переважна більшість PHK тварин, бактерій і ДНК-вмісних вірусів.
Цей процес називають транскрипцією. Він здійснюється за принципом комплементарності азотистих основ нуклеотидів. Інакше кажучи, синтезується ланцюг PHK, нуклеотидна послідовність якого комплементарна послідовності нуклеотидів одного з ланцюгів ДНК. Відмінність полягає лише в тому, що замість азотистої основи тиміну, характерної для ДНК, у PHK включається урацил.
Шляхом транскрипції утворюються всі основні види рибонуклеїнових кислот. Це, по-перше, інформаційні або матричні PHK, які надходять у рибосоми і реалізують одержану інформацію в процесі синтезу білка. Інформаційна PHK може нести інформацію про структуру одного, двох і більшої кількості полінуклеотидних ланцюгів. У першому випадку таку іРНК називають моноцистронною, а в другому – поліцистронною. Моноцистронні іРНК характерні для еукаріотів, а поліцистронні – для прокаріотів. Крім іРНК у процесі транскрипції утворюються рРНК і тРНК, які також відіграють важливу роль у біосинтезі білка.
Для синтезу PHK на матриці ДНК необхідна наявність усіх чотирьох видів нуклеотидів у формі трифосфатів. Цей процес можна подати схемою:

Реакцію каталізує фермент ДНК-залежна РНК-полімераза або просто РНК-полімераза. Її виявлено в усіх прокаріотичних і еукаріотичних організмах. Найкраще вивчено РНК-полімеразу, виділену з кишкової палички. Вважають, що в кишковій паличці є лише один вид полімерази, яка каталізує процеси синтезу всіх трьох видів PHK. Полімераза – це складний білковин комплекс із загальною молекулярною масою 480000. До складу цього ферменту входить 5 білкових субодиниць: дві a-субодиниці, b-, b¢- і s-субодиниці. Комплекс, який містить дві a-, b-, b¢-субодиниці, носить назву корферменту (від англ. core – серцевина). Він виявляє певну каталітичну активність, однак не здатний вибирати точку (місце) початку транскрипції. Взаємодія корферменту з s-субодиницею приводить до утворення холоензиму РНК-полімерази, який має всі її властивості. Всі субодиниці у холоферменті сполучені між собою слабкими хімічними зв'язками.
Характерною особливістю РНК-полімерази, по-перше, є те, що вона за допомогою s-субодиниці здатна вибирати ланцюг ДНК, з якого здійснюватиметься транскрипція, а також місце, з якого розпочинатиметься цей процес. По-друге, для початку синтезу PHK не потребує затравки, як ДНК-полімераза. Слід підкреслити, що РНК-полімераза не просто синтезує PHK, а й регулює цей процес за участю ряду додаткових кофакторів. Тому повністю оправдано застосування до PHK-полімерази поняття „РНК-полімеразна система”.
РНК-полімерази виділено також і з культури клітин людини, тимусу телят, печінки щурів. У кожному випадку з ядерної фракції було виділено три різні ферменти: РНК-полімеразу І (A), РНК-полімеразу II (В) і РНК-полімеразу III (C), які відрізнялися між собою кількістю субодиниць у молекулі і їх молекулярною масою. Вважають, що РНК-полімераза І каталізує в основному синтез рибосомальних PHK, РНК-полімераза II – синтез матричних PHK, a PHK-полімераза III, очевидно, – синтез транспортних PHK і 5S рРНК.
РНК-полімерази мають два активних центри. Один з них зв'язує 3'–ОН групи рибози кінцевого нуклеотиду ланцюга PHK, який синтезується, і має назву Т-центр, а другий – нуклеотиди, які приєднуються до ланцюга PHK, що росте, і має назву П-центр.
Процес матричного синтезу PHK за участю РНК-полімераз поділяють на три стадії: ініціація синтезу, елонгація (подовження) нуклеотидного ланцюга і термінація – завершення синтезу PHK і вивільнення ферменту. В цілому всі ці стадії становлять цикл транскрипції.
Ініціація. На цій стадії РНК-полімераза взаємодіє з невеликою ділянкою ДНК, утворюючи комплекс, який здатний розпочинати зв'язування рибонуклеозидтрифосфатів і ініціювати синтез PHK. Хоч РНК-полімераза виявляє велику спорідненість до всіх ділянок ДНК, проте найміцніше вона сполучається лише ділянками, які характеризуються певними послідовностями нуклеотидів на одному з ланцюгів матричної ДНК. Ці ділянки називають промоторами. Вони багаті АТ-парами нуклеотидів і піримідиновими блоками. Вважають, що специфічність взаємодії PHK-полімерази з певними ділянками ДНК-матриці зумовлена наявністю в цих ферментах d-субодиниць (d-факторів).
Зв'язування РНК-полімерази з промоторною ділянкою ДНК приводить до часткового розходження спіралі ДНК, що важливо для початку транскрипції PHK. На цій стадії РНК-полімераза за участю Т-центру взаємодіє з 3–ОН групою рибози першого нуклеозидтрифосфату, з якого розпочинається синтез нової молекули рибонуклеїнової кислоти. При цьому від нього не відщеплюється залишок пірофосфату. Першим нуклеотидтрифосфатом в основному є АТФ або ГТФ. Далі РНК-полімераза другим активним центром (П-центром) взаємодіє з другим нуклеотидтрифосфатом. Останній за участю фосфодіефірного зв'язку приєднується до 3'-вуглецевого атома рибози першого нуклеозидтрифосфату. При цьому вивільнюється Т-центр ферменту і відщеплюється пірофосфат від другого нуклеозидтрифосфату.
Елонгація. На стадії елонгації перший активний центр ферменту зв'язується з 3¢–ОН групою рибози другого нуклеотиду і РНК-полімераза переміщується (транслокується) на поверхні ДНК в напрямку росту ланцюга. За цих умов другий активний центр ферменту сполучається з наступним (третім) нуклеотидом. Останній знову за участю фосфодіефірного зв'язку сполучається з другим нуклеозидмонофосфатом. Так відбувається ріст (синтез) нуклеотидного ланцюга в напрямку 5 ® 3 до повного завершення біосинтезу PHK.
Спід зазначити, що в системах in vivo швидкість елонгації досягає близько 40 – 50 нуклеотидів за секунду, у системах in vitro цей процес проходить менш інтенсивно – 15 – 40 нуклеотидів за секунду. Разом з цим транскрипція здійснюється з досить великою точністю. Частота помилок становить 2×10-3 – 2×10-4 тобто на 2000 – 20 000 нуклеотидів може включатись один неправильний нуклеотид. Хоч ці помилки і малі, однак вони значно більші, ніж помилки при реплікації ДНК, де частота помилок становить 10-10. Однією з причин цього є те, що в процесі реплікації бере участь додатковий механізм контролю – виправляння помилок за участю ДНК-полімерази І.
Термінація. Процес обриву ланцюга, порівняно з іншими процесами синтезу PHK менш вивчений. Вважають, що ДНК має специфічні, термінуючі послідовності нуклеотидів. РНК-Полімераза, підходячи до них, перестає функціонувати. При цьому синтезований полінуклеотидний ланцюг PHK і молекула ферменту відділяються від ДНК-матриці.
Безпосереднім продуктом транскрипції є різні види PHK. Їх називають первинними транскриптами, або попередниками відповідних цитоплазматичних PHK, і позначають пре-РНК. Процес перетворення даних пре-РНК у функціонально активні форми PHK називається процесингом, або дозріванням. Процесинг відбувається в ядрі і має свої особливості для кожного виду PHK.
Важливою групою первинних транскриптів в ядрі є так звана гетерогенна ядерна PHK (гя-РНК). Основну фракцію гя-РНК становить матрична (інформаційна) PHK (пре-мРНК).
Для більшості пре-мРНК, синтезованих в ядрі еукаріот, існує три основні етапи процесингу: кепування і метилювання 5'-кінця, поліаденілування 3¢-кінця, видалення (вирізання) некодуючих ділянок (інтронів) з полінуклеотидного ланцюга та сполучення (зшивання) кодуючих ділянок (екзонів). Цей процес називається сплайсингом (від англ. Spticing – з'єднувати, зплітати).
Для мPHK, які синтезуються в клітинах прокаріот, процесинг не характерний.
Модифікація полінуклеотидних кінців пре-мPHK відбувається так. До 5'-кінця пре-мРНК приєднується олігонуклеотид, який називають „кепом”, або „ковпаком”. „Кеп” складається з двох-трьох метильованих нуклеотидів. Кінцевим нуклеотидом „кепа” є 7-мегилгуанозин, сполучений з полінуклеотидним ланцюгом PHK не по типу 5' ® 3', а 5' ® 5'-фосфодіефірним зв'язком. Вважають, що метильований „кеп” захищає мРНК від руйнування ферментами.
До 3'-кінця пре-мРНК приєднується поліаденіловий фрагмент – полі (А), який складається з 150 – 200 аденілових нуклеотидів. Вважають, що полі (А) – фрагмент, очевидно, необхідний для транспорту мРНК з ядра в цитоплазму, а також для підвищення її стабільності. Сплайсинг пре-мРНК відбувається шляхом вилучення неінформативних ділянок (інтронів), починаючи з 5¢-кінця за участю екзо- та ендонуклеаз. Інформативні ділянки, які залишились, тобто екзони, за участю спеціальних РНК-лігаз сполучаються в єдиний полінуклеотидний ланцюг.
Певним змінам (процесингу) піддаються й інші пре-РНК, зокрема пре-рРНК і пре-тРНК.
Пре-рРНК є попередником рибосомних PHK як у клітинах прокаріот, так і еукаріот. У прокаріот всі три рРНК – 25S, 16S і 5S утворюються з однієї молекули пре-рРНК – 30S, яка має молекулярну масу ~ 2×106. Спочатку окремі азотисті основи, що входять до її складу, піддаються етилюванню. На наступному етапі пре-рРНК розщеплюється з утворенням 17S- і 25S-проміжних PHK. Далі від них поступово за участю нуклеаз відщеплюються нуклеотиди й утворюються характерні для прокаріот 16S і 23S-рРНК. 5S-рРНК утворюється окремо з 3'-кінцевої ділянки пре-рРНК.
В еукаріот 18S, 28S і 5,8S-рРНК утворюються в декілька етапів з великої 45S пре-рРНК. Процесинг відбувається в ядерці. Спочатку проходить також метилювання нуклеотидів, а потім відщеплення нуклеотидів, що призводить до утворення 18S, 28S і 5,8S-pPHK.
тРНК також утворюються з довших полінуклеотидних ланцюгів пре-тРНК шляхом ферментативного відщеплення зайвих нуклеотидів з 5'- і 3'-кінців молекули. У багатьох випадках з однієї молекули пре-тРНК утворюється дві і більше (до 7) молекул тРНК. У ході процесингу крім відщеплення нуклеотидів з кінців полінуклеотидного ланцюга проходить ще ряд змін. По-перше, з окремих пре-тРНК до 3'-кінця приєднується нуклеотидна послідовність ЦЦА, в інших пре-тРНК цей 3'-кінцевий триплет утворюється в процесі транскрипції. По-друге, багато азотистих основ нуклеотидів зазнають різних модифікацій (деякі метилюються, інші – дезамінуються, відновлюються тощо).
І, нарешті, слід зазначити, що синтез PHK істотно відрізняється від реплікації ДHK. Насамперед, він є консервативним, а не напівконсервативним – продукт синтезу не включає жодних компонентів матриці. Цікавим є і той факт, що ферменти синтезу PHK, тобто PHK-полімерази, специфічні відносно різних матриць і навіть їх окремих ділянок. Крім того, для матричного синтезу PHK не потрібна затравка. Процес синтезу починається взаємодією двох нуклеотидів. І, нарешті, процес транскрипції, на відміну від реплікації, проходить переважно з одного полінуклеотидного ланцюга ДНК-матриці.
Розпад нуклеїнових кислот в тканинах
В процесі життя відбувається постійне самооновлення клітин організму. Ці явища пов'язані з синтезом і розпадом молекул ДНК і РНК. Клітини епітелію дванадцятипалої кишки оновлюються протягом 1,6 діб, рогівки ока – 6,9, мезотелія плеври – 33,9, миготливого епітелію трахеї – 47,6 діб. Тривалість життя тромбоцита до 8 діб, лейкоцита до 13, еритроцита до 120 діб.
Нуклеїнові кислоти клітин під впливом нуклеаз (ДНК-ази і РНК-ази) розщеплюються до мононуклеотидів. Екзонуклеази розщеплюють до мононуклеотидів зовнішні ділянки молекул ДНК і РНК, ендонуклеази – внутрішні. Частина мононуклеотидів може використовуватися новою клітиною, для синтезу власних нуклеїнових кислот, інші мононуклеотиди розщеплюються на нуклеозид і фосфат, потім – на пентозофосфат і пуринову або піримідинову основу:
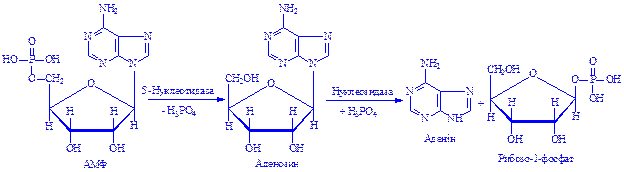
На другому етапі розщеплення реакцію каталізують ферменти, специфічні для кожного нуклеозида.
Таким чином, у результаті розщеплення нуклеотидів утворюються пуринові і піримідинові основи, фосфати пентоз, фосфорна кислота. Пентози можуть використовуватися як енергетичний матеріал. Основи зазнають ряд глибоких перетворень.
– Конец работы –
Эта тема принадлежит разделу:
З історії розвитку біохімії
Лекція Методи дослідження в біохімії Живі системи та їх організація НАПРЯМИ І МЕТОДИ ДОСЛІДЖЕННЯ В... Лекція Біогенні вуглеводи Загальна... Лекція Біогенні ліпіди Загальна характеристика будова та функції...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Проміжний обмін нуклеїнових кислот
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов