рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- З історії розвитку біохімії
Реферат Курсовая Конспект
З історії розвитку біохімії
З історії розвитку біохімії - раздел Химия, Вступ ...
Вступ
З історії розвитку біохімії
Залежно від об'єкту вивчення розрізняють біохімію людини (медичну біохімію), тварин, рослин, мікробів і вірусів. За напрямом вивчення організмів… Багато закономірностей, які встановлені біохімічними методами, є загальними… Результати багатьох біохімічних досліджень мають прикладне значення. Так, в самостійну галузь була виділена клінічна…Лекція № 1. Методи дослідження в біохімії. Живі системи та їх організація.
НАПРЯМИ І МЕТОДИ ДОСЛІДЖЕННЯ В БІОХІМІЇ
Обмін речовин складається з двох взаємозв'язаних і взаємообумовлених процесів – асиміляція і дисиміляція. Асиміляція – це комплекс фізіологічних і… У різних органах, тканинах і клітинах утворюються окремі речовини, необхідні… Біохімічні методи використовуються головним чином для вивчення закономірностей процесів асиміляції і дисиміляції в…ХІМІЧНИЙ СКЛАД ТВАРИННОГО ОРГАНІЗМУ
Елемент Середній вміст в організмі тварини, % Елемент Середній вміст в організмі … Хімічні елементи беруть неоднакову участь в побудові живої матерії. Частина з них є макроелементами О, С, H, Ca, К, N,…Таблиця 1.
Клітина – елементарна жива система, структурна і функціональна одиниця…Таблиця 2.
Таким чином, в клітині на одну молекулу ДНК доводиться в середньому 44 молекули РНК, 700 молекул білка і 7000 молекул ліпідів. Наприклад, гепатоцит…БІОЛОГІЧНІ МЕМБРАНИ
Основні поняття і терміни біологічної хімії
Умовно обмін речовин включає такі рівні: загальний, проміжний та внутрішньоклітинний. Загальний обмін включає процеси надходження поживних речовин в… Обмін речовин складається з фізіологічних (травлення, всмоктування, виділення)… Асиміляція– це частина загального обміну, що супроводжується поглинанням органічних сполук з навколишнього середовища,…Лекція № 2. Біогенні вуглеводи.
Загальна характеристика, будова та функції вуглеводів
Вуглеводи широко поширені в природі. Вони утворюються в рослинах у результаті реакцій фотосинтезу і складають 80 – 90% їх сухої маси. В організмі… Значення вуглеводів багатогранно. Так, вони є основою структури рослинної… За хімічними властивостями вуглеводи є альдегідо- і кетоспиртами. За будовою вуглеводи ділять на дві групи – прості,…А. Моносахариди
Моносахариди – білі кристалічні речовини, добре розчинні у воді, солодкі на смак, оптично активні, вступають у хімічні реакції, характерні для… Тріози. Загальна формула – C3H6O3. За хімічними властивостями є альдегідо- і…Б. Полісахариди
Дисахариди (біози). Це вуглеводи, молекули яких при гідролізі розщеплюються на дві молекули гексоз. Розрізняють дисахариди мальтозного (мальтоза, лактоза, целобіоза, гентибіоза,… При найменуванні дисахаридів за звичай користуються назвами (лактоза, мальтоза, сахароза), що історично склалися,…Лекція № 3 . Біогенні ліпіди.
Загальна характеристика, будова та функції ліпідів
Ліпіди не розчиняються або слабо розчиняються у воді, добре розчиняються в органічних розчинниках. Більшість ліпідів є похідними спиртів, вищих… Розрізняють дві групи ліпідів: прості і складні. Молекули простих ліпідів… Нейтральні жири. Нейтральні жири є сумішшю тригліцеридів – складних ефірів, утворених трьохатомним спиртом гліцерином…Таблиця 1.
Фізичні і хімічні константи деяких жирів
Кислотне число свідчить про наявність у складі жиру вільних жирних кислот, які утворилися при розкладанні його молекул. Воно визначається числом… Розглянуті константи залежать від зони проживання, умов живлення, віку, статі,… Діольні ліпіди. Ці ліпіди були відкриті в тканинах рослин і тварин радянським вченим Л.Д. Бергельсоном в 1967 – 1973…Лекція № 4. Білки. Амінокислоти.
Білки. Амінокислоти
Функції білків
За участю ферментів у клітинах одночасно проходить багато різних хімічних реакцій, які забезпечують синтез і розщеплення різноманітних сполук з… Структурна функція. Білки в середньому становлять 18 – 21 % загальної сирої… Транспортна функція. Білки виконують також важливу транспортну функцію. Для нормальної життєдіяльності кожного…Хімічний склад білків
Амінокислотний склад. Разом з визначенням елементного складу білків було розпочато вивчення і їх будови. Спочатку вважали, що основними структурними… У 1820 р. А. Браконно вперше при кислотному гідролізі білка (желатини) виділив… Отже, в другій половині XIX ст. було встановлено, що основними структурними компонентами білка є амінокислоти.Амінокислоти
Білки, крім того можуть містити й інші компоненти, однак трьохвимірна структура, а відповідно, й їх біологічне значення визначається в основному… Амінокислоти в клітинах виконують багато важливих функцій; деякі з біологічно… Біологічне значення. Амінокислоти являючись будівельними блоками пептидів і білків, виконують і ряд інших важливих…Таблиця 1
1) За виключенням гідроксилізину і гідроксипроліну, які включаються до молекул білків у вигляді лізину та проліну, а…Таблиця 2
Класифікація L-a-амінокислот, які входять до складу білків,
Основана на полярності їх R–груп
Амінокислоти, які знаходяться у вільному стані або які входять до складу інших сполук (не білків), виконують важливі функції в багатьох метаболічних…Таблиця 3
Деякі амінокислоти, які не входять до складу білків, але відіграють важливу
Роль в метаболізмі організму
Розчинність амінокислот. Амінокислоти містять по декілька заряджених груп, тому вони легко піддаються сольватації і добре розчиняються в полярних розчинниках (вода, етанол) і не розчиняються в неполярних розчинниках (бензол, гексан, ефір). Температура плавлення амінокислот досить велика (> 200°C). Це теж обумовлено присутністю в них заряджених груп.
Загальні хімічні властивості амінокислот, які визначаються властивостями карбоксильної і аміногруп
Властивості карбоксильної групи
Як і всі інші сполуки, що містять карбоксильну групу, амінокислоти при взаємодії з основами утворюють солі, а в результаті реакцій із спиртами і… Важливу роль в біохімії відіграє реакція декарбоксилування амінокислот, в…Властивості аміногрупи
Як і всі сполуки, що містять аміногрупу, амінокислоти взаємодіють з кислотами, утворюючи солі. Відділення аміногрупи від амінокислоти може бути здійснено багатьма способами.…Методи визначення N-кінцевих амінокислот
Ця реакція може відбуватися і за участю амінокислот, що входять в білок, але тільки по їх вільних аміногрупах. Якщо…Флуорескамін є ще більш чутливим реагентом, який дозволяє виявляти амінокислоти в кількості порядку нанограм. Як і нінгідрин, він утворює комплекс не тільки з амінокислотами, але і іншими амінами.
Утворення пептидних зв’язків. Найбільш важливою реакцією, в якій приймають участь амінокислоти, є утворення пептидних зв’язків. При цьому виділяється одна молекула води:
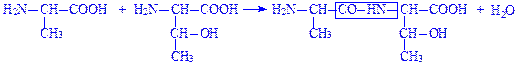
Однак, реакція здійснюється не так, як показано на малюнку, оскільки рівновага сильно зміщення в сторону гідролізу пептичного зв’язку. Для утворення пептидного зв’язку між двома амінокислотами карбоксильна група повинна бути попередньо активована. Хімічний синтез здійснюється шляхом попереднього утворення хлорангідриду. Біологічна активація включає взаємодію з АТФ.
Властивості індивідуальних амінокислот. Гліцин, найменша з амінокислот, може локалізуватися в таких областях трьохвимірної структури, які недоступні для інших.
Аліфатичні R–групи аланіну, валіну, лейцину і ізолейцину, а також ароматичні R-групи фенілаланіну, тирозину і триптофану – гідрофобні; ця властивість призводить до одного важливого наслідку – утворення впорядкованого поверхневого шару молекул води в області поверхні молекули білка, де експоновані неполярні R–групи. Заряджені R–групи основних і кислих амінокислот відіграють важливу роль в стабілізації специфічної конформації білка шляхом утворення сольових зв’язків. Крім того, амінокислоти з позитивно і негативно зарядженими R–групами, а також гістидин можуть приймати участь у формуванні систем “перенесення заряду”, які в ході ферментативного каталізу забезпечують переміщення заряду на значні відстані. І на завершення, унікальна і важлива роль у ферментативному каталізі належить гістидину – рК імідазольної групи при рН=7 може позмінно виступати в ролі основного або кислотного каталізатора.
Первинна спиртова група серину і первинна тіоспиртова група (–SH) цистеїну є добрими нуклеофілами які приймають участь в ферментативному каталізі. Хоча вторинна спиртова група треоніну теж виявляє нуклеофільні властивості, але дані про її можливу каталітичну функцію відсутні. Окрім каталітичної функції –ОН група серину приймає участь в регуляції активності деяких ключових ферментів метаболізму, активність яких залежить від фосфорилювання окремих залишків серину.
Амінокислоти не поглинають світло в видимій частині спектру (іншими словами, вони не мають забарвлення). За виключенням ароматичних кислот і гістидину, вони не поглинають світло і в ультрафіолетовій області при довжинах хвиль вище 240 нм.
Методи виділення та ідентифікації амінокислот. Фракціонування і визначення окремих амінокислот. Деякі амінокислоти дають кольорові реакції або володіють характерним спектром поглинання, що створює можливість їх кількісного визначення. Існують, проте, і більш загальні методи, що дозволяють ідентифікувати, а потім і визначити вміст кожної з амінокислот в суміші після фракціонування. Ці методи можуть бути використані при дослідженні тканинних екстрактів, біологічних рідин (плазми крові, сечі) або білкових гідролізатів, в яких зв'язок між амінокислотами вже розірваний.
Хроматографія на папері (Мартін, Гордон і Синдж). Цей метод відіграє важливу роль при аналізі амінокислот, і сама техніка хроматографії на папері була розроблена саме для цієї мети.
Коли мають справу з складною сумішшю амінокислот, наприклад при аналізі гідролізата білків, доводиться вдаватися до двомірної хроматографії. При проведені хроматографії в одному напрямі часто використовують як розчинник фенол, а в перпендикулярному – суміш бутанола і водного розчину оцтової кислоти. Амінокислоти проявляють за допомогою нінгідрина при підвищеній температурі. Амінокислоти, які відносяться до однієї групи, розташовуються на одній плавній кривій.
Іонообмінна хроматографія на колонці (Мур і Стейн). Цей метод дозволяє проводити кількісне визначення амінокислот у суміші. Скляну колонку заповнюють смолою, яка містить на матриці полістиролу угрупування – SO3H-Na+. В кислому середовищі амінокислоти поводять себе як основи. Вони утворюють катіони, здатні витісняти частину іонів Na+ і, займаючи їх місце, затримуватися на колонці. Чим більш основною є дана амінокислота, тим міцніше вона зв'язується електростатичними силами із смолою. Потім через колонку пропускають елюючу рідину, поступово збільшуючи її рН (градієнт рН). Коли рН елюента наближається до значення рН, відповідного даній амінокислоті, вона відділяється від смоли і починає рухатися уздовж колонки. Оскільки величини pHi для різних амінокислот неоднакові, амінокислоти виходять з колонки по черзі. Необхідно, проте, мати на увазі, що міцність зв'язку між амінокислотою і смолою обумовлена не тільки електростатичними силами, а залежить також від сил іншої природи. Тому в деяких випадках порядок виходу амінокислот може не відповідати порядку зміни величини рНi. Процес проведення хроматографії залежить від температури. Методика колоночної хроматографії використовується в двох варіантах:
а) в поєднанні з колектором фракцій. Амінокислоти збирають в окремі пробірки у вигляді невеликих фракцій. В кожну з пробірок додають нінгідрин і нагрівають (реакцію з нінгідрином проводять зазвичай при підвищеній температурі). За допомогою спектрофотометра вимірюють потім спектри поглинання кожної з фракцій і, виходячи з отриманих даних, обчислюють концентрацію кожної амінокислоти. Таким чином одержують серію кривих, що відповідають послідовному виходу амінокислот. Природу кожної амінокислоти встановлюють за об'ємом елюента, що витрачається на зняття цієї амінокислоти із смоли, з урахуванням заздалегідь проведених калібрувальних дослідів;
б) з автоматичним аналізатором, що працює за таким принципом. Рідина, що витікає з колонки, за допомогою насоса змішується з нінгідрином. Суміш проходить спочатку через водяну баню, де підігрівається, а потім через кювету спектрофотометра, який безперервно реєструє поглинання світла при 570 нм (фіолетове забарвлення нінгідрииа зі всіма амінокислотами) і при 440 нм (жовте забарвлення проліна з нінгідрином). Дані спектрофотометра реєструються на стрічці, що рухається, або на листі паперу. Площа, яка обмежена кривою і базовою лінією, пропорційна концентрації відповідної амінокислоти.
Електрофорез. Завдяки своєму електричному заряду амінокислоти можуть переміщуватися в електричному полі (рис. 1). Проте через малий розмір молекул вони легко дифундують і тому їх розділення можливе тільки при використанні твердої основи, наприклад паперу або крохмалю. Розділення йде по групах. Так, наприклад, при рН 4,0 дикарбонові амінокислоти ще залишаються кислотами і аніонами. Вони прямують до позитивного полюса – аноду. Нейтральні ж і лужні амінокислоти рухаються в цих умовах до негативного полюса – катоду, оскільки при рН 4,0 вони несуть позитивний заряд.
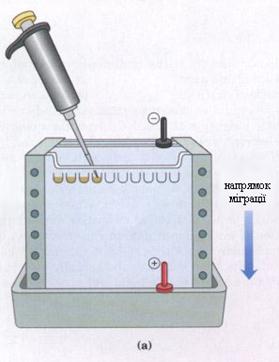

Рис. 1. Прилад для проведення електрофорезу (а), електрофореграма (b).
Будова білків
Характеристика зв’язків амінокислот у молекулах білка. Для нативних білків, що мають специфічні фізико-хімічні та біологічні властивості,… Припущення відносно сил, що забезпечують утворення стабільних структур, було… Отже, стабілізація структури білкової молекули забезпечується за рахунок ковалентних зв’язків та сил слабкої…Характеристика конформацій поліпептидів
Рис. 4. Вторинна структура: (а) – площинна; (b) – α-спіраль;Фізико-хімічні властивості білків
Іонна сила (m) розчину іонізованої солі визначається як половина суми концентрації кожного іона, помножена на квадрат його валентності (тобто… де с – концентрація кожного з іонів; Z – електричний заряд іона (електровалентність).Визначення молекулярної маси білків
Осмотичний тиск. Якщо речовина, розчинена у воді, відокремлена від чистої води мембраною, проникною для води і непроникною для цієї речовини, то… де p – осмотичний тиск в атмосферах; R – універсальна газова постійна; С – мольна концентрація розчиненої речовини; T…Класифікація білків
Відомо понад 2000 білків тваринного, рослинного і мікробного походження. Їх класифікують переважно за фізико-хімічними властивостями та хімічним… Залежно від фізико-хімічних властивостей, хімічного складу і значення… Альбуміни. Ці білки містяться в крові, лімфі, лікворі, насінні рослин, мікробах. До альбумінів належать лактальбумін,…Хімічний склад і будова нуклеїнових кислот
Нуклеотиди – це трикомпонентні сполуки. Вони складаються з пуринових або піримідинових основ, пентоз і фосфорної кислоти. З пуринових основ до…Таблиця 1.
Компоненти нуклеїнових кислот і їх позначення
Назва нуклеотидів походить від назви основ, що входять до їх складу, або від назви нуклеозиду. Так, якщо нуклеотид містить азотисту основу аденін,… Аналогічний принцип назви властивий і для нуклеотидів, які замість рибози містять дезоксирибозу. Відмінність полягає…Будова нуклеїнових кислот
На кінцях полінуклеотидного ланцюга знаходяться пентози. Один ланцюг містить вільну групу ОН в положенні 3¢ а другий – фосфорильовану групу ОН… Нуклеїнові кислоти залежно від хімічного складу, структури і біологічної ролі… Рибонуклеїнові кислоти побудовані з рибонуклеотидів, які крім залишку фосфорної кислоти містять вуглеводний компонент…Властивості нуклеїнових кислот
Оскільки молекули нуклеїнових кислот асиметричні, то їх розчини мають високу в'язкість. В'язкість розчинів нуклеїнових кислот використовується для… Для нуклеїнових кислот характерна також висока оптична активність. Їх розчини… Усі нуклеїнові кислоти мають здатність поглинати світло в ультрафіолетовій області з максимумом 260 нм. Порушення…Функції нуклеїнових кислот
Основна кількість ДНК зосереджена в ядрах. Ядра тваринних клітин містять близько 2 мг ДНК на 1 г сирої маси тканини. Вміст ДНК у клітинах залежить в… Передача генетичної інформації від покоління до покоління здійснюється при…Загальні відомості
Роботи, виконані в нашій країні і за рубежем по вивченню вітамінів, послужили основою для створення вчення про вітаміни – вітамінології. Великий… Отже, вітаміни це – група низькомолекулярних органічних речовин, необхідних… 1. Біосинтез вітамінів здійснюється в основному поза організмом людини і тварин. Тому вони одержують вітаміни головним…Жиророзчинні вітаміни
Вітамін А. Дія вітаміну була відома задовго до нашої ери. На способи запобігання авітамінозу вказував ще Гіппократ (460 – 377 до н.е.). Спочатку… Гіпо- і авітамінози. При недостатній кількості вітаміну А в раціоні… До недостатньої кількості вітаміну в раціоні особливо чутливі молоді організми: діти, телята, поросята і курчата. При…Водорозчинні вітаміни
До водорозчинних відносяться вітаміни B1, B2, B3, В5, B6, Вс, B12, H, С і P. Вітамін В1. Вітамін В1 (тіамін) – один з перших вітамінів, відкритих наукою.… Гіпо- і авітамінози. При недостатній кількості або відсутності в раціоні вітаміну В1 розвиваються гіпо- і авітамінози.…Вітаміноподібні речовини
Гіпо- і авітамінози. У людини при недостатній кількості речовини виникають розлади нервової системи, знижується перистальтика кишечнику. У тварин… Хімічна будова і властивості. Вітамінною активністю володіє мезоінозит (1, 2,…Коротка історія вчення про ферменти
Історія біохімії в значній мірі є історією вивчення ферментів. Розвиток вчення про ферменти можна умовно розбити на декілька етапів. Перший етап… Другий етап включає період з XVII ст. до середини XIX ст. і зв’язаний з іменем… Третій етап починається з другої половини XIX ст. і продовжується до 30-х років XX ст. У другій половині XIX ст.…Біосинтез і клітинна локалізація ферментів
Біосинтез молекули ферменту відбувається в кожній клітині, тканині, органі і складається з тих же етапів, що і біосинтез звичайного білка: Перші два етапи є типовими матричними процесами. Третій етап – це типовий синтез білкової молекули. На четвертому…Методи виділення і очищення ферментів
Молекули ферментів зазвичай зв’язані із структурними білками, ліпідами і вуглеводами, які входять до складу органоїдів і клітинних мембран. Частина… Матеріал, призначений для отримання ферментів, звільняють від домішок (органи… Очищення ферментів зазвичай є чергуванням різних методів фракціонування. Зокрема, більшість ферментів можна очистити,…Загальні властивості ферментів
Термолабільність і температурний оптимум дії ферментів. Ферменти – термолабільні сполуки. При дії високих температур вони денатуруються, що…Оптимальні значення рН для деяких ферментів
Рис. 3. Залежність активності ферментів від рН середовищаКатіони металів, які активують деякі ферменти
Розрізняють оборотне і необоротне гальмування. Прикладом оборотного… Розрізняють два типи активації і гальмування ферментів: алостеричне або просторове, і субстратне або конкурентне. За…Хімічна природа ферментів
Для ферментів-білків характерна будова, типова для цього класу сполук. Для ряду ферментів була визначена первинна, вторинна, третинна і четвертна… Молекули ферментів зазвичай мають великі розміри і складну просторову… Периферійні частини молекули ферменту беруть участь в підтримці і формуванні просторової конфігурації активного…Коферменти. Простетичні групи
Нікотінамідаденіндинуклеотид (НАД). Цей кофермент відноситься до універсальних по розповсюдженню і біологічній ролі. Містить каталітично активне…Зоферменти
Найбільш детально вивчені ізоферменти ЛДГ, яка здійснює перетворення молочної і піровиноградної кислот. Молекулярна маса ЛДГ складає 140 тис. Її… Фракції відрізняються між собою біологічною роллю. Так, анодні фракції… Спектр ізоферментів може змінюватися в різні періоди онтогенезу і при патології. Його визначення дає можливість…Механізм дії ферментів
Ферменти і енергія активації. Ферменти – це біологічні каталізатори. Вони впливають на швидкість реакцій в двох напрямах: прискорюють розщеплення… Теорія ферментативного каталізу. Існуючі теорії, пояснюючи взаємодію ферменту… I етап. Між субстратом і ферментом виникає зв’язок, внаслідок чого утворюється фермент-субстратний комплекс ES, в…Номенклатура і класифікація ферментів
На V Міжнародному біохімічному конгресі, що проходив у 1961 р. в Москві, була прийнята нова класифікація і номенклатура ферментів. За основу був… 1. Оксидоредуктази – ферменти, які каталізують окисно-відновні реакції. 2. Трансферази – ферменти, які каталізують реакції міжмолекулярного перенесення різних хімічних груп і залишків.Оксидоредуктази
Відомо понад 200 оксидоредуктаз. Вони об’єднані в 14 підкласів. За тривіальною номенклатурою ферменти розділяються відповідно до характеру… За систематичною номенклатурою в назві ферменту вказується субстрат-донатор,… 1.1. Оксидоредуктази, які діють на CH–ОН-групу донорів. Залежно від природи акцептора підклас ділиться на чотири…Трансферази
А + Ф « В + ФТ; ФТ + Д « ДТ + Ф. Клас трансфераз об’єднує близько 800-та ферментів. Він складається з восьми… 2.1. Трансферази, які діють на одновуглецеві залишки. Залежно від природи залишку в підкласі розрізняють три…Гідролази
R1R2 + HOH « R1H + R2OH Гідролази широко поширені в природі. Вони беруть участь в обміні нуклеїнових… 3.1. Гідролази, які діють на складноефірні зв’язки. За тривіальною номенклатурою їх називають естеразами. Підклас…Ліази
Ліази – це ферменти, що каталізують реакції негідролітичного відщеплення певних груп від субстратів з утворенням подвійних зв’язків або реакції приєднання цих груп по подвійних зв’язках. Деякі ліази, на відміну від лігаз, здійснюють реакції синтезу окремих речовин без участі макроергічних сполук. Більшість ліаз – складні білки, що містять в молекулах фосфорні ефіри водорозчинних вітамінів. Клас складається з шести підкласів: вуглець-вуглець-ліази, вуглець-кисень-ліази, вуглець-азот-ліази, вуглець-сірка-ліази і вуглець-галоїд-ліази та ін.
4.1. Вуглець-вуглець-ліази. Ферменти, які здійснюють в основному розрив С–С-зв’язків. В підклас входять три підпідкласи: карбокси-ліази, альдегід-ліази і ліази кетокислот. Типовим представником є піруватдекарбоксилаза (карбокси-ліаза 2-оксокислот, КФ 4.1.1.1), яка здійснює декарбоксилування:
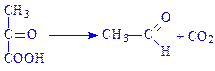
4.2. Вуглець-кисень-ліази. Їх часто називають гідроліазами, або дегідратазами (гідратазами). Самим вивченим ферментом підкласу є карбонат-дегідратаза, або карбоангідраза (карбонат – гідро-ліаза, КФ 4.2.1.1), що каталізує реакцію:
H2CO3 = CO2 + H2O
4.3. Вуглець-азот-ліази. Це ферменти, які здійснюють відщеплення від певних субстратів аміаку або амідинових груп. Наприклад, аспартат – аміак-ліаза (L-аспартат –аміак-ліаза, КФ 4.3.1.1) дезамінує аспартат:

Фермент аргініносукцинат-ліаза (L-аргініносукцинат – аргінін-ліаза, КФ 4.3.2.1) розкладає аргінінянтарну кислоту:
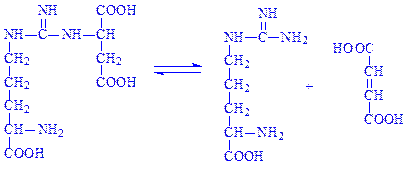
4.4. Вуглець-сірка-ліази. Це ферменти, за допомогою яких розщеплюється зв’язок між вуглецем і сіркою. Прикладом є цистеїндесульфгідраза (L-цистеїн:сірководень-ліаза (дезамінуюча), КФ 4.4.1.1), що каталізує реакцію:
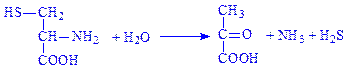
До інших підкласів ліаз належать також вуглець-галоїд-ліази (4.5) і фосфор-кисень-ліази (4.6). Із інших ліаз (4.99) відомий такий фермент, як феррохелатаза (4.99.1.1), що каталізує включення заліза в молекулу гема.
Зомерази
5.1. Рацемази і епімерази. Каталізують реакції інверсії асиметричних груп в молекулах різних речовин. Розрізняють чотири підпідкласи: рацемази і… Ферменти, що здійснюють перетворення субстратів з декількома асиметричними атомами вуглецю, називаються епімеразами.…Взаємозв’язок між ферментами
Зв’язок між ферментами може носити різний характер. Наприклад, в порожнині шлунку під впливом пепсину починається розщеплення білків продуктів… Існує спадкоємність в діяльності ферментів різних класів. Так, поживні… У ряді випадків взаємозв’язок ферментів між собою здійснюється генетично, тобто кодується генетичною інформацією,…Ферменти в народному господарстві, медицині, ветеринарії і зоотехнії
У медицині і ветеринарії широко застосовується ензимодіагностика. Так, багато захворювань печінки (жовтяниця, гепатити, цирози) діагностуються по… Багато ферментів застосовуються з терапевтичною метою. Так, препарат трипсину…Загальна характеристика гормонів
За хімічною природою гормони є білками (інсулін), пептидами (окситоцин), стероїдами (андростерон), похідними амінокислот (тироксин), фенолами… Для більшості гормонів розшифрована будова їх молекул. Багато гормонів… Діяльність залоз внутрішньої секреції контролюється нервовою системою (схема 1).Гормони гіпоталамуса
Хімічна природа. В ядрах гіпоталамуса синтезується, принаймні, сім стимуляторів (рилізинг-факторів) і три інгібітори (рилізинг-гальмуючі фактори)… Тироліберин (тиротропін-рилізинг фактор, ТРФ) має будову…Гормони гіпофіза
А. Гормони передньої частини гіпофіза (аденогіпофіза).Гормони епіфіза
Мелатонін. Мелатонін відноситься до найбільш вивчених гормонів епіфіза. Відкритий у 1917 р. як речовина, що впливає на пігментацію шкіри. Хімічна природа. Мелатонін – О-метилпохідне індола. Біосинтез. Місцем утворення гормону є пінеальні клітини. Він синтезується з триптофана через ряд проміжних…Гормони щитовидної залози
Тироксин. Е. Кендалл у 1915 р. виділив з гідролізата щитовидної залози речовину, що оберігає від розвитку зобу, і назвав його тироксином… Хімічна природа. Йодовані похідні амінокислоти тирозина. Гормони існують в трьох формах: тиреоглобулін (основна форма), тироксин (циркулює в біологічних рідинах) і 3, 5,…Гормон паращитовидної залози
Паратгормон. Хімічна природа. Паратгормон є поліпептидом, складається з 75 – 80 амінокислотних залишків з молекулярною масою в середньому 8500,… Біосинтез. Гормон синтезується в головних клітинах паращитовидної залози з… Метаболізм. Синтезований гормон поступає в кровоносне русло, розноситься по всьому організму де і проявляє свою…Гормон навколовушної залози
Хімічна природа. Паротин – це поліпептид, складається з 16 – 17 амінокислотних залишків. Біосинтез. Гормон синтезується в клітинах залози з амінокислот. Метаболізм. Синтезований гормон поступає в кровоносну систему і з током крові розноситься по всьому організму. Після…Гормон вилочкової залози
Хімічна природа. Тимозин за хімічною природою є поліпептидом з молекулярною масою 7000. Біосинтез. Гормон синтезується з амінокислот. Біосинтез протікає рибосомальним… Метаболізм. Синтезований гормон поступає в кровоносну систему і з током крові розноситься по всьому організму. Після…Гормони підшлункової залози
Інсулін. Відкриття інсуліну пов'язано із з'ясуванням причин цукрового діабету. Гормон відкрив Л.В. Соболєв у 1902 р. Ф. Бантінг і Ч. Бест у 1921 р.… Хімічна природа. Молекула інсуліну складається з мономерів, які можуть між… Інсуліни різних тварин відрізняються між собою залишками амінокислот в положеннях 8, 9 і 10 А-ланцюга.Чоловічі статеві гормони
Хімічна природа. Перший андроген був отриманий Я. Бутенандтом у 1932 р. і названий андростероном. Всі андрогени є похідними циклічного вуглеводня –… Найбільший інтерес представляють андростерон, дегідроандростерон, тестостерон та їх синтетичний аналог –…Жіночі статеві гормони
Хімічна природа. Жіночі статеві гормони можна розділити на п'ять груп: естрогени, гестагени, релаксин, андрогени і гормони плаценти. Естрогени і гестагени є похідними циклопентанпергідрофенантрена. Естроген в… Молекула естрогену в ядрі А містить три подвійні зв'язки:Гормони кори наднирників
Гормони кори наднирників почали вивчати після робіт Т. Аддісона (1855), який встановив, що причиною бронзової хвороби є дегенерація клітин кори… Хімічна природа. За фізіологічною дією гормони ділять на чотири групи: · глюкокортикоїди (кортикостерон, гідрокортикостерон, кортизон),Гормони мозкової речовини наднирників
Хімічна природа. Гормони є похідними діоксібензола (катехола або пірокатехіна). Їх називають катехоламінами: В органах і тканинах, особливо в наднирниках і симпатичній нервовій системі, міститься L-адреналін, який у 15 – 40…Гормоноїди
Простагландини. Простагландини вперше були знайдені в спермі людини. Ульф ван Ейлер у 1936 р. виділив ці речовини з витяжки передміхурової залози і… Хімічна природа. Всі ці речовини за своїм агрегатним станом є рідинами або…Загальні уявлення про обмін речовин і енергії
Розглядаючи життя як вищу форму руху живої матерії, як спосіб існування біополімерних тіл та систем, здатних до самооновлення і самовідтворення в… Умовно обмін речовин поділяють на загальний, проміжний та внутрішньоклітинний.… Обмін речовин складається з фізіологічних (травлення, всмоктування, виділення) і фізичних (сорбція, дифузія, осмос),…Енергетичний баланс організму. Макроергічні сполуки
У процесі еволюції в живих організмах сформувались механізми, які забезпечують сприймання або вилучення енергії, генерацію, акумулювання її та… Залежно від способу вилучення енергії всі живі організми поділяють на фото- і… Для гетеротрофних організмів основним джерелом енергії, яка необхідна для забезпечення процесів життєдіяльності, є…Біологічне окислення
При диханні, як і при згоранні, відбувається поглинання кисню і утворення CO2 і H2O. Енергетичний ефект окислення органічних сполук в організмі та… Перші спроби з'ясувати особливості та механізм окислення сполук в організмі… На початку XX cт. O.H. Бах та K. Енглер одночасно і незалежно один від одного запропонували гіпотезу, згідно з якою…Таблиця 1
1) Оксидази. Істинні оксидази каталізують видалення водню із субстрату,…Аеробні дегідрогенази – флавопротеїни; містять простетичні групи – флавінмононуклеотид (ФМН) або флавінаденіндинуклеотид (ФАД).
До ферментів групи аеробних дегідрогеназ відноситься дегідрогеназа L-амінокислот (оксидаза L-амінокислот) ФМН-вмісний фермент, який знаходиться в нирках і володіє широкою специфічністю, каталізує окисне дезамінування природних L-амінокислот. Широко поширена ксантиндегідрогеназа (ксантиноксидаза); вона виявлена в молоці, у тонкому кишечнику, нирках і печінці.
Ксантиндегідрогеназа містить молібден; відіграє важливу роль у перетворенні пуринових основ у сечову кислоту в печінці і нирках. Особливе значення має для птахів, які екскретують сечову кислоту як головний кінцевий азотовмісний продукт метаболізму пуринів, а також катаболізму білків і амінокислот.
Альдегіддегідрогеназа – ФАД-вмісний фермент, що знаходиться в печінці. Це – металофлавопротеїн – містить молібден і негемове залізо, окислює альдегіди і N-гетероциклічні субстрати.
Глюкозооксидаза – ФАД-специфічний фермент, який одержують із грибів. Вона важлива тим, що використовується при визначенні глюкози.
Механізм окислення і відновлення, що здійснюється цими ферментами, дуже складний. Судячи з наявних даних, відбувається двостадійне відновлення ізоаллоксазонового кільця з проміжним утворенням семіхінона (вільного радикала):
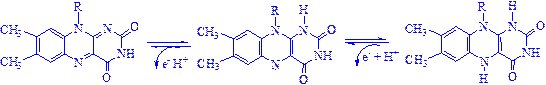
3) Анаеробні дегідрогенази – ферменти, які каталізують видалення водню із субстрату, але не здатні використовувати кисень як акцептор водню. До цього класу належить велике число ферментів. Вони виконують дві функції:
а) перенесення водню з одного субстрату на інший в спряженій окисно-відновній реакції:
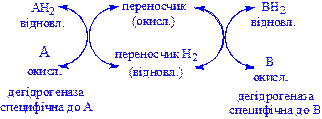
Ці дегідрогенази специфічні до субстратів, але часто використовують один і той же кофермент або переносник водню. Оскільки реакції, які розглядаються оборотні, то вони забезпечують у клітині вільне перенесення відновних еквівалентів. Реакції цього типу призводять до окислення одного субстрату за рахунок відновлення іншого, особливо важливі для здійснення окисних процесів за відсутності кисню.
б) функцію компонентів дихального ланцюга забезпечуючи транспорт електронів від субстрату на кисень:

Поділяються на:
Дегідрогенази, залежні від нікотинамідних коферментів. До цієї категорії належить багато дегідрогеназ. Вони специфічні або до нікотинамідаденіндинуклеотиду (НАД+), або до нікотинамідаденіндинуклеотидфосфату (НАДФ+), які виконують роль коферментів (рис. 1). НАД+ і НАДФ+ утворюються в організмі людини з вітаміну В5. Для синтезу НАД+ чи НАДФ+ ферменти, які знаходяться в цитозолі більшості клітин, використовують тільки нікотинову кислоту, але не нікотинамід. Нікотинамідний фрагмент НАД+ утворюється з нікотинатного фрагмента, коли останній знаходиться в складі нуклеотиду; амідна група надходить від глутаміну (рис. 1).
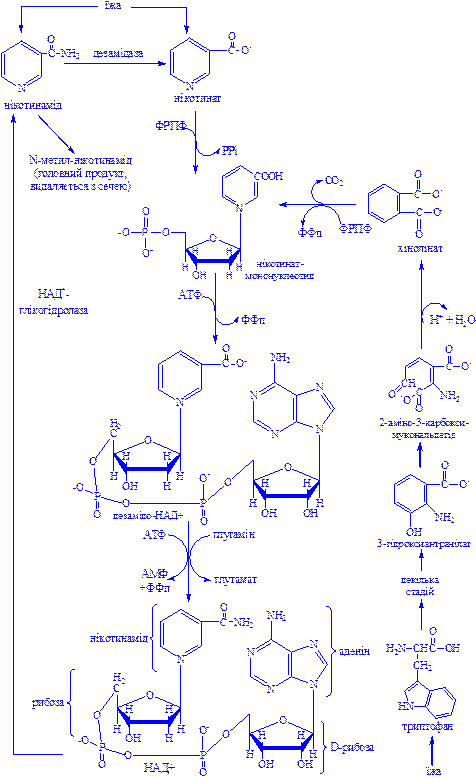
Рис 1. Синтез і розклад нікотинамідаденіндинуклеотиду (НАД).
Є дані про те, що в мітохондріях для синтезу НАД+ використовується нікотинамід. Коферменти відновлюються специфічними субстратами дегідрогеназ і окислюються адекватним акцептором електронів (рис. 2).

НАД+ + AH2 D НАДH + H+ + A
Рис 2. Механізм окислення і відновлення нікотинамідних коферментів.
У загальному випадку НАД-залежні дегідрогенази каталізують окисно-відновні реакції окисних шляхів метаболізму – гліколізу, циклу лимонної кислоти, дихального ланцюга мітохондрій. НАДФ-залежні дегідрогенази беруть участь у процесах відновного синтезу, зокрема у позамітохондріальному синтезі жирних кислот і стероїдів; вони також є коферментами дегідрогеназ пентозофосфатного шляху. Деякі дегідрогенази, які функціонують з нікотинамідними коферментами, містять іон цинку, зокрема алкогольдегідрогеназа печінки і гліцеральдегід-3-фосфатдегідрогеназа скелетних м'язів. Припускають, що іони цинку не беруть участь безпосередньо в процесах окислення і відновлення.
Рибофлавінзалежні дегідрогенази. Флавінові групи цих дегідрогеназ ті ж, що й в аеробних дегідрогеназ, ФМН і ФАД. Більшість рибофлавін-залежних анаеробних дегідрогеназ або бере участь у транспорті електронів по дихальному ланцюзі, або поставляє електрони для цього ланцюга. НАДФ-дегідрогеназа – компонент дихального ланцюга, яка переносить електрони від НАДН до більш електропозитивних компонентів. Інші дегідрогенази, наприклад сукцинатдегідрогеназа, ацил-СоА-дегідрогеназа і мітохондріальна гліцерол-3-фосфат-дегідрогеназа переносять відновні еквіваленти від субстрату безпосередньо на дихальний ланцюг. Ще одна функція флавін-залежних дегідрогеназ – каталіз дигідроліпоїл-дегідрогеназою дегідрування відновленого ліпоату (інтермедіату при окисному декарбоксилуванні пірувату й a-кетоглутарату). У цьому випадку внаслідок низького значення окисно-відновного потенціалу системи ліпоату переносником водню від відновленого ліпоату до НАД+ є флавопротеїн (ФАД). Електрон-переносний флавопротеїн є проміжним переносником електронів між ацил-СоА-дегідрогеназою і дихальним ланцюгом.
в) Цитохроми. За винятком розглянутої вище цитохромоксидази, цитохроми класифікуються як анаеробні дегідрогенази. Їх ідентифікація і вивчення полегшуються тією обставиною, що у відновленому стані вони мають характерні смуги в спектрі поглинання, які зникають при окисленні. У дихальному ланцюзі вони служать переносниками електронів від флавопротеїнів до цитохромоксидази. Цитохроми є залізовмісними гемопротеїнами, у яких атом заліза переходить зі стану Fe2+ у Fe3+ і назад у процесі окислення і відновлення. До складу дихального ланцюга входять цитохроми b, с1, с, а і а3 (цитохромоксидаза). З них розчинним є тільки цитохром с. Крім дихального ланцюга цитохроми містяться в ендоплазматичному ретикулумі (цитохроми Р450 і b5), у рослинних клітинах, бактеріях і дріжджах.
Відновлення нікотинаміду субстратом (АН2) по положенню 4 відбувається стереоспецифічно. Один з атомів водню переноситься від субстрату в положення 4 у виді ядра водню з двома електронами (гідрид-іон, Н- ): він може приєднатися або в А-, або у В-положенні в залежності від специфічності дегідрогенази, яка каталізує дану реакції. Інший водень, який відщеплюється від субстрату, залишається вільним у виді іона водню.
4) Гідроксипероксидази – ферменти, які використовують як акцептор перекис водню або органічні перекиси. До цієї категорії відносяться два типи ферментів: пероксидази, які знаходяться в складі молока, в рослинах, лейкоцитах, тромбоцитах, еритроцитах і т.д., і каталаза, яка функціонує в тканинах тварин і рослин.
Пероксидаза. Спочатку пероксидази вважалися рослинними ферментами, пізніше вони були виявлені також у молоці, лейкоцитах, тромбоцитах, а також у тканинах, у яких відбувається метаболізм ейкозаноїдів. Простетичною групою є протогем, який на відміну від гемових груп більшості гемопротеїнів дуже слабко зв'язаний з апоферментом. У реакції, яку каталізує пероксидаза, перекис водню відновлюється за рахунок сполук, що виступають як донори електронів, таких, як аскорбат, хінони чи цитохром с. Реакція, яку каталізує пероксидаза, має складний характер; сумарна реакція виглядає в такий спосіб:
Н2О2 + АН2  2Н2О + А
2Н2О + А
В еритроцитах глутатіонпероксидаза, яка містить як простетичну групу – селен, каталізує розклад Н2О2 і гідроперекисів ліпідів відновленим глутатіоном і в такий спосіб захищає ліпіди мембран і гемоглобін від окислення перекисами.
Каталаза. Гемопротеїн, який містить чотири гемові групи. Поряд з пероксидазною активністю каталаза здатна використовувати одну молекулу Н2О2 як донор електронів, а іншу – як окислювач, тобто акцептор електронів. In vivo у більшості випадків каталаза розкладає пероксид водню:
2Н2О2  2Н2О + О2
2Н2О + О2
Каталаза міститься у крові, кістковому мозку, мембранах слизових оболонок, нирках і печінці. Її функція – розкладання перекису водню, що утворюється при дії аеробних дегідрогеназ. У багатьох тканинах, включаючи і печінку, виявлені мікротільця, пероксисоми, які багаті аеробними дегідрогеназами і каталазою. Очевидно, біологічно вигідно групувати як ферменти, що призводять до утворення Н2О2, так і ферменти, що розкладають його в одному місці:
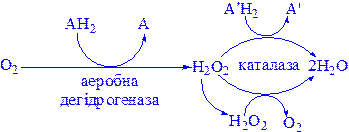
До ферментів, що забезпечують утворення Н2О2, крім пероксисомних ферментів відносяться також мітохондріальні і мікросомні системи транспорту електронів.
5) Оксигенази – ферменти, які каталізують пряме введення кисню в молекулу субстрату.
Оксигенази не належать до ферментів, що каталізують реакції, які збагачують клітину енергією; вони беруть участь у синтезі і розкладі багатьох типів метаболітів. Ферменти цієї групи каталізують включення кисню в молекулу субстрату.
Воно відбувається в дві стадії: 1) кисень зв'язується з активним центром ферменту; 2) відбувається реакція, у результаті якої зв'язаний кисень відновлюється чи переноситься на субстрат. Оксигенази діляться на дві підгрупи.
а) Діоксігенази (кисень-трансферази, істинні оксигенази). Ці ферменти каталізують включення в молекулу субстрату обох атомів молекули кисню:
А + О2 ® АО2.
Приклад – залізовмісні ферменти гомогентизатдіоксігеназа і 3-гідроксиантранілат-діоксігеназа із супернатантної фракції гомогенату печінки, а також гемвмісні ферменти, зокрема L-триптофандіоксігеназа (триптофанпіролаза) з печінки.
б) Монооксигенази (оксидази зі змішаною функцією, гідроксилази). Ці ферменти каталізують включення в субстрат тільки одного з атомів молекули кисню. Інший атом кисню відновлюється до води; для цього необхідний додатковий донор електронів (косубстрат):
А–Н + О2 + ZH2 ® А–ОН + Н2О + Z
Мікросомні цитохром Р450-вмісні монооксигеназні системи. До цієї групи належать ферменти, які беруть участь у метаболізмі багатьох лікарських речовин шляхом їх гідроксилювання. Вони знаходяться в мікросомах печінки разом з цитохромом Р450 і цитохромом b5. Відновниками цих цитохромів є НАДН і НАДФН (рис. 3); цитохроми окислюються субстратами в результаті серії ферментативних реакцій, які складають так званий гідроксилазний цикл (рис. 4):
Лік–Н + О2 + 2Fe2+(P450) + Н+  Лік–ОН + Н2О + 2Fe3+
Лік–ОН + Н2О + 2Fe3+
(Лік – лікарська речовина).

Рис 3. Ланцюг транспорту електронів в мікросомах.
Ціанід (CN-) гальмує стадію, вказану на рисунку.

Рис 4. Цитохром Р450-гідроксилазний цикл у мікросомах.
До лікарських речовин, метаболізм яких відбувається за участю розглянутих систем, відносяться: бенз[a]пірен, амінопірин, анілін, морфін і бензофетамін. Багато лікарських речовин, наприклад фенобарбітал, здатний індукувати синтез мікросомних ферментів і цитохрому Р450.
Мітохондріальні цитохром Р450-вмісні монооксигеназні системи. Ці системи знаходяться в стероїдогенних тканинах – у корі наднирників, у сім’яниках, яєчниках і плаценті; вони беруть участь у біосинтезі стероїдних гормонів з холестеролу (гідроксилювання по С22 і С20 при відщепленні бічного ланцюга і по положеннях 11b і 18). Ферменти ниркової системи каталізують гідроксилювання 25-гідроксихолекальциферолу по положеннях 1a і 24; у печінці відбувається гідроксилювання холестеролу по положенню 26 при біосинтезі жовчних кислот. У корі наднирників вміст мітохондріального цитохрома Р450 у шість разів вище, ніж вміст цитохромів дихального ланцюга. Монооксигеназна система складається з трьох компонентів, локалізованих у внутрішній мітохондріальній мембрані на границі з матриксом: НАДФ-специфічного ФАД-вмісного флавопротеїну, Fе2S2-білка (адренодоксину) і цитохрома Р450 (рис. 5).

Рис 5. Мітохондріальна цитохром Р450-монооксигеназна система.
Наведена система типова для гідроксилаз стероїдів у корі наднирників. Мікросомна цитохром Р450-гідроксилаза печінки не має потреби в присутності залізо-сірчаного білка Fe2S2. Оксид вуглецю (СО) гальмує зазначену на рисунку стадію.
Fe2S2 – залізо-сірчаний білок (адренодоксин). Оскільки НАДФ(H) не може проникати в мітохондріальну мембрану, джерелами відновних еквівалентів є такі субстрати, як малат і ізоцитрат, для яких усередині мітохондрій є специфічні НАДФ-залежні дегідрогенази.
Метаболізм супероксид-радикала. Кисень є потенційно токсичною речовиною. Донедавна його токсичність пов'язували з утворенням Н2О2. Однак останнім часом, приймаючи на увагу, по-перше, ту обставину, що кисень у тканинах легко відновлюється в супероксидний аніон-радикал (O2-.), і, по-друге, наявність в аеробних організмів супероксиддисмутази (СОД) (її немає в облігатних анаеробів), було висунуто припущення про те, що токсичність кисню обумовлена його перетворенням у супероксид. Однак прямих даних про токсичність супероксид-радикала поки не отримано.
Супероксид утворюється в ході одноелектронного окислення молекулярним киснем відновленого флавіну, наприклад флавіну в складі ксантиндегідрогенази. Він утворюється також при одноелектронному окисленні молекулярним киснем відновленого компонента дихального ланцюга:
Enz–H2 + O2 ® Enz–H + O2-. + H+.
Супероксид може відновлювати окислений цитохром с:
О2-. + Цит с (Fе3+) ® О2 + Цит с (Fе2+).
Він відщеплюється також специфічним ферментом – супероксиддисмутазою:
О2-. + О2-. + 2Н+  Н2О2 + О2
Н2О2 + О2
У цій реакції супероксид виступає одночасно як окислювач, так відновник. Хімічна дія супероксиду в тканинах підсилюється в результаті ініціювання ланцюгової реакції утворення вільних радикалів. Було висловлено припущення, що О2-., зв'язаний з цитохромом Р450, є інтермедіатом при активації кисню в процесі реакцій гідроксилювання (рис 4).
Функцією супероксиддисмутази є, очевидно, захист аеробних організмів від ушкоджуючої дії супероксиду. Фермент виявляється в декількох внутрішньоклітинних кампартментах. Цитозольний фермент складається з двох подібних субодиниць, які містять по одному іонові Сu2+ і Zn2+; мітохондріальний фермент, так само як і фермент, виявлений у бактерій, містить іон Мn2+. Ця обставина служить ще одним доказом на користь гіпотези про походження мітохондрій із прокаріот, що вступили в симбіоз із протоеукаріотами. Дисмутаза присутня у всіх основних тканинах аеробів. Перебування тварин в атмосфері 100%-ного кисню викликає адаптивне підвищення вмісту дисмутази, особливо в легенях; тривале перебування в такій атмосфері призводить до ушкодження легень і летальному результату. Антиоксиданти, наприклад a-токоферол (вітамін Е), здатні вловлювати вільні радикали, такі, як О2-., знижуючи тим самим токсичність кисню.
Окислювальне фосфорилювання
У процесі гліколізу проходить ще одна реакція фосфорилюючого окислення (на рівні субстрату) – при перенесенні активного фосфорилу з… На третьому етапі виділення енергії (під час аеробного окислення в циклі… ІТФ + АДФ ® АТФ + ГДФ.Перетравлювання вуглеводів
У ротовій порожнині їжа механічно подрібнюється, змочується слиною, перемішується і перетворюється на харчову грудку. Слина – змішаний секрет трьох залоз: привушної, підщелепної і під'язикової. Це… Їжа, що містить крохмаль, інулін і глікоген, під впливом ферменту амілази піддається гідролітичному розщепленню:Всмоктування вуглеводів
Пентози всмоктуються повільніше, ніж гексози. Гексози всмоктуються, головним чином, у вигляді гексозофосфатів, що перешкоджає вирівнюванню… , ,Проміжний обмін
Цукор крові. Цукор крові, в основному, представлений глюкозою, частково – фруктозою і глікогеном (табл. 1).Таблиця 1
Вміст цукру в крові людини і деяких тварин
Глюкоза знаходиться у вільному і зв'язаному станах. У деяких випадках кількість зв'язаної глюкози досягає 40 – 50% загального її вмісту в крові,… Існує два основні шляхи поповнення вмісту глюкози у крові – всмоктування… Печінка виділяє у кров у середньому 3,5 мг глюкози на 1 кг маси тіла за 1 хв. Виділення глюкози печінкою залежить від…Синтез глікогену
Вміст глікогену в печінці людини і тварин при надмірному вуглеводному живленні іноді складає 15 – 20% загальної сухої маси органу. В печінці людини… Якщо для синтезу глікогену джерелом служить глюкоза, цей процес називають… Глікогенез. Утворення глікогену детально вивчено в печінці. В гепатоцитах глюкоза під впливом гексокінази…Розпад глікогену
Зменшення вмісту цукру в крові рефлекторно призводить до розпаду глікогену в печінці і нормалізації вмісту глюкози в крові. Ці процеси регулюються… Розщеплення глікогену здійснюється двома шляхами: фосфоролізом і гідролізом.… Бічні відгалуження молекули глікогену відщеплюються під впливом гідролітичного ферменту аміло-1,6-глюкозидази.Анаеробне розщеплення вуглеводів
Цей процес протікає в органах, тканинах і клітинах живого організму без участі кисню. Його основні реакції схожі з хімізмом спиртового бродіння,… Анаеробне розщеплення вуглеводів може починатися фосфоролітичним розщепленням… Фосфоролітичне розщеплення глікогену до глюкозо-1-фосфата відбувається під впливом ферменту фосфорилази:Спиртове бродіння
У нижчих організмів – дріжджових і цвілевих грибів, деяких мікроорганізмів – процес анаеробного перетворення вуглеводів завершується утворенням… C6H12O6 ® 2С2Н5ОН + 2СО2. Хімізм цього процесу досить близький до гліколізу, який протікає в тканинах вищих організмів. Усі стадії перетворення…Аеробне перетворення вуглеводів
Аеробне й анаеробне перетворення вуглеводів тісно зв'язані між собою. Це насамперед виявляється в тому, що обидва процеси проходять однаково включно… Якщо вуглеводи перетворюються в анаеробних умовах, то піровиноградна кислота,… Процес перетворення піровиноградної кислоти до ацетил-КоА дістав назву окислювального декарбоксилування. Каталізується…Пентозний цикл
Пентозний цикл – це ланцюг послідовних хімічних перетворень вуглеводів, у результаті якого в тканинах і клітинах звільняється хімічна енергія і…Глюкозо-6-фосфат + 7Н2О + 12НАДФ+ ® 6СО2 + 12НАДФ×Н2 + 5 Глюкозо-6-фосфат + H3PO4.
Отже, виходячи із сумарного рівняння бачимо, що при повному окисленні 1 молекули глюкози утворюється 12 молекул відновленого НАДФ, які в процесі… Пентозному циклу належить важлива роль в синтезі жирів. Так, у жировій тканині… Окрім описаних вище шляхів перетворення вуглеводів, в тканинах тваринних організмів були знайдені інші цикли, зокрема,…Біосинтез дисахаридів
Важливими представниками дисахаридів є сахароза, лактоза, мальтоза та деякі інші. Біосинтез їх здійснюється в основному за реакціями… Фермент, який каталізує цю реакцію, виділений з бактерій. Очевидно, в них так відбувається синтез сахарози.Кінцевий обмін
Основними кінцевими продуктами обміну вуглеводів є вода і вуглекислий газ. Вода виділяється з сечею, потом, каловими масами, повітрям, що видихається. Вуглекислий газ виділяється легенями з повітрям, що видихається. В сечі міститься деяка кількість глюкуронової кислоти, яка, знешкоджуючи отруйні речовини, утворює парні сполуки. В калі містяться неперетравлені через якісь причини або важко переварювані (лігнін, клітковина) вуглеводи.
Регуляція вуглеводного обміну
Існує прямий зв'язок між вмістом глюкози в крові і функціональним станом центральної нервової системи. Так, зменшення концентрації глюкози в крові… У регуляції вуглеводного обміну беруть участь гормони гіпофіза, коркової і… Посередником між гормонами і ферментами є циклічна форма АМФ (цАМФ), яка „вмонтована” в мембрани клітин. Її діяльність…Патологія вуглеводного обміну
Гіперглікемія – збільшення вмісту цукру в крові вище за норму. Гіперглікемія призводить до глюкозурії – появі глюкози в сечі. Причиною цих явищ може… З порушеннями обміну вуглеводів пов'язані порушення обміну інших речовин і,… Порушення процесів гліконеогенеза викликає надмірне руйнування білків і збільшення вмісту в крові і сечі продуктів…Біологічна роль ліпідів в організмі
В організмах людини і тварин ліпіди входять до складу всіх клітин. Однак розподілені вони між різними органами і тканинами нерівномірно і кількість… Значна частина ліпідів входить до складу клітин організму як пластичний… Ліпіди в організмі виконують важливу енергетичну функцію. За рахунок жирів їжі в середньому на 25 – 35 %…Таблиця 1.
Добова потреба організму людини в жирах залежно від характеру
Трудової діяльності
Перетравлювання ліпідів
У ротовій порожнині харчі, що містять ліпіди, механічно подрібнюються, перемішуються, змочуються слиною і перетворюються на харчову грудку. У складі… Подрібнені харчові маси по стравоходу поступають в шлунок (у жуйних –… З шлунку кормові маси невеликими порціями поступають в дванадцятипалу кишку, потім в тонку і клубову. Тут завершується…Всмоктування ліпідів
Ліпідні речовини і продукти їх розщеплення проникають у порожнину клітини покривного епітелію двома способами: через субмікроскопічні канальці… У людини і тварин 10% жиру всмоктується у вигляді тригліцеридів, 10% – у ди- і… Продукти перетворення ліпідів складаються з дрібних частинок жиру, ди- і моногліцеридів, вищих жирних кислот,…Проміжний обмін
Ресинтез ліпідів. В епітеліальних клітинах слизової оболонки відбувається розпад комплексів на ліпідну частину і переносник. Якщо переносником були… Ресинтез ліпідів починається в ендоплазматичній сітці апікальної частини і… В епітеліальних клітинах з молекул синтезованих ліпідів, крапельок жиру, що всмокталися, вітамінів (А, D, E, К, F) і…Біосинтез ліпідів
Біосинтез жирів. Біосинтез жирів складається з трьох основних етапів: синтез гліцерину, вищих жирних кислот і сполучення їх в молекули… Синтез гліцерину. Близько 60% гліцерину утворюється з продукту проміжного…Ліполіз
Перетворення жирів. Під впливом тканинних ліпаз, які активуються солями фосфорної кислоти, нейтральні жири розщеплюються до гліцерину і вищих жирних… Цей процес найбільш інтенсивно протікає в печінці і легенях. Продукти розпаду жиру відрізняються за своєю хімічною…Кінцевий обмін
Жири. При повному окисленні жиру в тканинах утворюється вуглекислий газ і вода. Так, якщо до складу молекули жиру входять залишки стеаринової,… С55Н104О6 + 78O2 = 55СО2 + 52H2O. Дихальний коефіцієнт (співвідношення між кількістю вуглекислого газу, який утворився при окисленні жиру, і кількістю…Регуляція ліпідного обміну
Центральна нервова система корелює різні гормональні впливи на ліпідний обмін. Окремі гормони сприяють накопиченню організмом ліпідів (наприклад,… Інтенсивність і спрямованість ліпідного обміну залежать і від складу раціону.…Патології ліпідного обміну
При зниженому синтезі ліполітичних ферментів травними залозами і зменшенні секреції жовчі (фасциолез, гепатити) порушуються процеси перетравлювання… Відсутність у раціоні ліпотропних речовин (холіна і метіоніна) викликає жирове… Ліпідний обмін порушується при кетозах. Вони виникають при цукровому діабеті, гепатитах, різних отруєннях. Їх причиною…Перетравлювання білків
У ротовій порожнині їжа, що містить білки, механічно подрібнюється, змочується слиною і перетворюється на харчову грудку, яка по стравоходу поступає… Пережовані харчові маси поступають у шлунок (у жуйних в сичуг), перемішуються… Шлунковий сік – біологічна рідина, яка синтезується залозами слизової оболонки шлунку. Це безбарвна і злегка…Всмоктування білків
Рис. 1. Схема транспортування амінокислот через мембрану:Проміжний обмін
Основна маса амінокислот витрачається на біосинтез білків, частина – на біосинтез біологічно активних речовин (небілкових гормонів, пептидів, амінів… Біосинтез білків. Проблема біосинтезу білка є однією з основних проблем… Біосинтез білка протікає у всіх органах, тканинах і клітинах. Найбільша кількість білка синтезується в печінці. Синтез…Кінцевий обмін
Перетворення аміаку. Аміак утворюється при дезамінуванні амінокислот, пуринових і піримідинових основ, нікотинової кислоти і її похідних, інших… Сечовина – головний кінцевий продукт азотного обміну у більшості хребетних і…Регуляція білкового обміну
Дія гормонів на біосинтез білка здійснюється шляхом стимуляції утворення іРНК. Гормон передньої частини гіпофіза – соматотропін – посилює синтетичні…Патології білкового обміну
Патології білкового обміну виявляються у різних формах. Білкове голодування. Розрізняють два види білкового голодування: первинне,… Порушення обміну амінокислот. При деяких хворобах печінки (гепатитах, цирозах, жовтяниці) у крові і сечі різко…Перетравлювання та всмоктування нуклеїнових кислот
У ротовій порожнині їжа, що містить нуклеопротеїди, механічно подрібнюється, змочуються слиною і у вигляді харчової грудки по стравоходу поступає в… У шлунку більшість нуклеопротеїдів під впливом пепсину і соляної кислоти… Процес перетравлювання нуклеопротеїдів завершується в тонкій кишці, де трипсин розщеплює залишки нуклеопротеїдів на…Проміжний обмін нуклеїнових кислот
Матеріалом для синтезу нуклеїнових кислот у клітинах можуть бути екзогенні продукти гідролітичного розщеплення ДНК і РНК їжі. Частину матеріалів для… Біосинтез пуринових нуклеотидів. Використання мічених атомів (15N і 13C)…Кінцевий обмін нуклеїнових кислот
Загальна схема розпаду пуринових основ для людини і тварин універсальна. Спочатку вони дезамінуються до гіпоксантина і ксантина, потім окислюються… В утворенні кінцевих продуктів обміну пуринових основ беруть участь декілька специфічних ферментів:Регуляція нуклеїнового обміну
Нуклеїновий обмін регулюється залозами внутрішньої секреції. Так, синтез РНК і ДНК стимулюється соматотропіном, гідрокортизоном, естрадіолом. Дія… Гальмування синтезу нуклеїнових кислот використовується в лікувальній…Патологія нуклеїнового обміну
Нуклеїновий обмін різко порушується при променевій хворобі. При цьому порушується процес реплікації ДНК, синтез РНК, гальмується клітинний поділ,… З патологією нуклеїнового обміну пов'язаний патогенез сечокам'яної хвороби,…Значення і розподіл води в організмі
Фізико-хімічна характеристика води. Хімічно чиста вода – це прозора рідина без запаху і смаку. Молекула води містить 11,19% водню і 88,81% кисню.… Вода – добрий розчинник багатьох органічних і мінеральних речовин, що… Середній кут зв'язку Н–О–H рівний 104,5°, середня міжатомна відстань Н–О – 0,0965 нм. Дипольний момент води – 1,86.…Обмін води
Всмоктування води. Вода всмоктується слизовою оболонкою всього харчового каналу, починаючи від ротової порожнини і закінчуючи прямою кишкою.… Частинки води разом з перевареними поживними речовинами проникають углиб… Проміжний обмін води. Після всмоктування вода транспортується до різних органів, тканин і клітин, де використовується…Загальна характеристика мінеральних речовин
За кількісним вмістом у живій матерії всі біогенні елементи ділять на дві групи: макро- і мікроелементи. Вміст макроелементів (О, H, С, N, Ca, S та… Біогенні елементи утворюють неорганічні і органічні речовини. Неорганічні… Найбільше мінеральних речовин міститься в кістках (48 – 74% загальної маси) і хрящах (2 – 10%). Решта органів і тканин…Обмін мінеральних речовин
Всмоктування мінеральних речовин. Певна кількість мінеральних речовин всмоктується в шлунку, основна маса – слизовою оболонкою тонкої кишки,… Частинки мінеральних речовин проникають у цитоплазму клітин покривного… Надлишок мінеральних речовин може викликати підвищення осмотичного тиску в організмі і зміну іонного складу…Таблиця 1.
Вміст мінеральних речовин у тваринних тканинах і органах
Мг% на сиру тканину
Через нирки з сечею виділяється натрій, калій, кобальт, кальцій, магній, вісмут, літій, сурма, хлор, бор, бром, йод, фтор, сірка та деякі інші… З калом виділяються головним чином залізо, кальцій, мідь, стронцій, алюміній,… Частина мінеральних речовин виділяється з потом. Мінеральні речовини виділяються у вигляді хлоридів, сульфатів,…Значення і обмін деяких хімічних елементів
Макроелементи
Чотири макроелементи складають органічну основу живих організмів. Це кисень (62,43%), вуглець (21,15%), водень (9,86%) і азот (3,10%). Решту… Кальцій. На частку кальцію доводиться майже третина всіх мінеральних речовин… Всмоктування кальцію відбувається переважно в тонкій кишці. Інтенсивність всмоктування залежить від вмісту кальцію в…Мікроелементи
Йод. В організмі йоду міститься до 0,027% загальної маси. Йод необхідний для синтезу гормонів щитовидної залози. В організм йод поступає з кормом,… Характеризується інтенсивним обміном (після введення 131J він через 10 – 15 хв… Надлишок йоду з організму видаляється з сечею, потом, молоком, калом, повітрям, що видихається.Регуляція на рівні мембрани
– Всмоктування вуглеводів в кишечнику є специфічним і активним процесом. Швидкість всмоктування для різних вуглеводів неоднакова. Активний транспорт… – Проникнення вуглеводів усередину клітини ставить складні проблеми. В… – Рух води і іонів в нирках до певної міри знаходяться під гормональним контролем. Іони Na+ реабсорбуються в основному…Метаболічний рівень регуляції
Регуляція активності ферментних систем здійснюється кількома шляхами – за участю специфічних і неспецифічних механізмів та зміни об'єму синтезу… Зміна концентрації субстратів досягається переважно за рахунок… Перебіг біохімічних реакцій у живих організмах здійснюється також у суворій послідовності, внаслідок чого створюється,…Оперонний рівень регуляції
Регуляція синтезу іРНК на оперонному рівні забезпечується за рахунок кількох механізмів, серед яких важливе значення має індукція і репресія,…Клітинний рівень регуляції
Суть ядерно-цитоплазматичних взаємовідносин полягає у взаємозалежному контролі синтезу важливих біополімерів клітин. Так, синтез структурних… Регуляція синтезу субодиниць ферментів у першому випадку забезпечується за… Такий ядерно-цитоплазматичний контроль характерний для синтезу багатьох білків-ферментів, зокрема таких, як…Організменний і популяційний рівні регуляції
Суть популяційного рівня регуляції полягає у взаємодії між певними популяціями за рахунок впливу хімічних сполук, що продукуються одними з них, на… Дослідження взаємовідносин між популяціями є предметом науки – хімічної…– Конец работы –
Используемые теги: історії, розвитку, біохімії0.062
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: З історії розвитку біохімії
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов