Будова білків - раздел Химия, З історії розвитку біохімії Всі Білки Являються Високомолекулярними Поліпептидами. Умовну Границю Між Вел...
Всі білки являються високомолекулярними поліпептидами. Умовну границю між великими поліпептидами і білками проводять в області молекулярних мас 8000 – 10000.
Характеристика зв’язків амінокислот у молекулах білка. Для нативних білків, що мають специфічні фізико-хімічні та біологічні властивості, характерним є наявність нижчих та вищих рівнів структури. Для кожного рівня структури характерні певні види зв’язків, за рахунок яких відбувається надійна стабілізація білкових молекул.
Припущення відносно сил, що забезпечують утворення стабільних структур, було висловлене Д.Л. Талмудом та С.Є. Бреслером у 1944 p. Наступні дослідження дали змогу на основі цих припущень сформулювати загальні положення про сили, що стабілізують білкові молекули. Згідно з даними положеннями структура білків є результатом дії таких сил: пептидних зв’язків між CO–NH–групами амінокислот; дисульфідних зв’язків, які утворюються між залишками амінокислоти цистеїну; водневих зв’язків між киснем карбонільної і воднем імінної груп пептидних угруповань; гідрофобної взаємодії.
Отже, стабілізація структури білкової молекули забезпечується за рахунок ковалентних зв’язків та сил слабкої взаємодії. При цьому в стабілізації кожного виду структури вирішальна роль належить одному із зв’язків, а решта відіграють допоміжну роль. Так, ковалентні зв’язки (сили міцної взаємодії) забезпечують стабілізацію первинної і третинної структур (пептидний та дисульфідний зв’язки). Решта видів структури стабілізується за рахунок сил слабкої взаємодії водневих та іонних зв’язків, сил Ван-дер-Ваальса, гідрофобної взаємодії тощо.
Пептидний зв’язок. Коли карбоксильна і аміногрупа з’єднуються, утворюючи пептидний зв’язок, амінокислоти перетворюються в амінокислотні залишки, утворюючи пептид.
Схематично даний процес можна записати так:
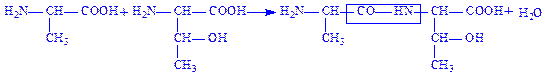
Пептид складається із двох або більше амінокислотних залишків, з’єднаних пептидними зв’язками.
Пептиди, які складаються більше ніж з 10 амінокислотних залишків називаються, поліпептидами.
Утворений дипептид може взаємодіяти з наступною амінокислотою, утворюючи трипептид, тетрапептид і т.д. Необхідно відмітити, що трипептид містить три залишки амінокислот, але не три пептидних зв’язки:

Структуру пептиду прийнято зображати так, щоб N-кінцевий залишок (містить вільну NH2–групу) розміщувався зліва, а С-кінцевий залишок (з вільною карбоксильною групою) – справа. Такий пептид має тільки одну вільну a-аміногрупу і тільки одну a-карбоксильну групу. Це твердження справедливе для всіх поліпептидів, які утворені тільки амінокислотними залишками, з’єднаними одна з одною пептидними зв’язками.
В деяких пептидах кінцева аміногрупа або кінцева карбоксильна група модифікована (прикладом може бути ацильне похідне аміногрупи або амід карбоксильної групи), і таким чином, не являється вільною.
Лінійна послідовність амінокислотних залишків в поліпептидному ланцюзі називається первинною структурою пептиду. Для того, щоб встановити первинну структуру пептиду необхідно встановити число, хімічну структуру і порядок розміщення всіх амінокислотних залишків, які входять до його складу.
Заміна всього лише однієї амінокислоти на іншу в лінійній послідовності із 100 і більше залишків може призвести до зниження або до повної втрати біологічної активності пептиду, а це сприятиме розвиткові серйозних наслідків (наприклад, виникнення серповидної анемії).
Поліпептиди (білки) можуть містити 100 і більше амінокислотних залишків, тому традиційні структурні формули виявляються завеликими для позначення молекули пептиду. В даному випадку користуються “хімічним скорописом”, використовуючи трьохбуквенні або однобуквені позначення амінокислотних залишків (табл. 1). При найменуванні пептиду, його розглядають як похідне С-кінцевого амінокислотного залишку.
Водневий зв’язок досить поширений в хімічних сполуках. Він утворюється між ковалентно зв’язаним атомом водню, який має частковий позитивний заряд, та іншими ковалентно зв’язаними атомами, що мають негативний заряд. У молекулах білка водневий зв’язок найчастіше утворюється при взаємодії атома водню імінної групи залишку однієї амінокислоти з атомами кисню карбонільної групи залишку іншої амінокислоти:
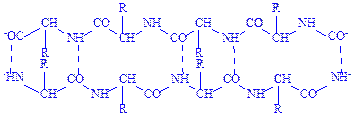
Водневий зв’язок у молекулі білка може бути внутрішньоланцюговим (з’єднує окремі витки однієї спіралі) і міжланцюговим (з’єднує різні поліпептидні ланцюги). У нативних білках цей тип зв’язку може утворюватися не лише між воднем і киснем пептидних груп, а й між іншими функціональними групами поліпептидного ланцюга.
Водневий зв’язок, на відміну від інших зв’язків, досить слабкий. Енергія цього зв’язку дорівнює 6 кДж, тоді як, наприклад, енергія зв’язку між атомами вуглецю становить близько 250 кДж. Тому водневий зв’язок легко утворюється і легко руйнується при звичайних умовах. Він відіграє важливу роль в утворенні вторинної, третинної і четвертинної структур білка.
Дисульфідний зв’язок. Відомо, що до складу переважної більшості білків входять залишки амінокислоти цистеїну. Цей досить міцний ковалентний зв’язок утворюється внаслідок відщеплення атомів водню від сульфгідрильних груп двох амінокислотних залишків цистеїну. Дисульфідний зв’язок, як і водневий, може бути внутрішньо ланцюговим (а) і міжланцюговим (б).
Схему утворення дисульфідного зв’язку можна показати так:
а)

б)

Дисульфідні зв’язки мають важливе значення для формування третинної структури білків. Руйнування цих зв’язків призводить до дестабілізації даного рівня структури і втрати білком його біологічної активності.
Іонний зв’язок утворюється при наявності у поліпептидних ланцюгах молекул білків залишків моноамінодикарбоновнх і діаміномонокарбонових кислот. Вільні карбоксильні та амінні групи цих залишків амінокислот перебувають переважно в іонізованому стані, в результаті чого між ними виникає електростатична взаємодія:
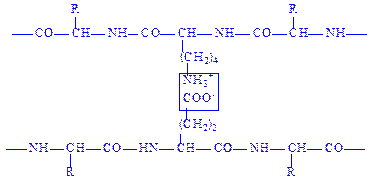
Іонний зв’язок відіграє важливу роль при утворенні третинної і, можливо, четвертинної структур білків.
Гідрофобний зв’язок утворюється внаслідок міжмолекулярної взаємодії (сил Ван-дер-Ваальса) між гідрофобними (неполярними) радикалами таких амінокислот, як аланін, валін, лейцин, ізолейцин, фенілаланін тощо:

Гідрофобний зв’язок має важливе значення для стабілізації третинної і четвертинної структур білків.
Структури білків. Основополагаючим моментом в нашому розумінні принципів організації білків послужило виявлення того факту, що поліпептидні ланцюги можуть знаходитися у високо впорядкованій конформації, яка стабілізується водневими зв’язками між пептидними групами. Внаслідок існування таких конформацій розрізняють рівні структурної організації білка (рис. 2).
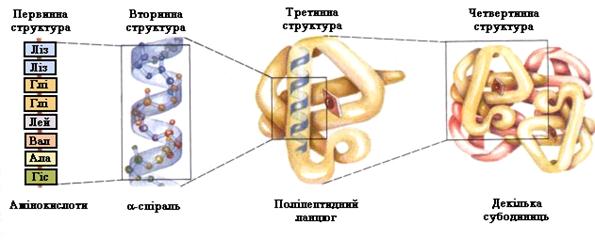
Рис. 2. Структури білкової молекули
Первинна структура білків – це послідовність амінокислот, зв’язаних пептидним зв’язком–СО–NH–. Унікальність первинної будови зумовлює функції та властивості білків, у тому числі імунні. Первинна будова білка кодується генетичним кодом у ДНК. Всі атоми пептидної групи компланарні, тобто знаходяться у одній площині, тому що мають делокалізовані p-електрони; О та Н розташовані у транс-положенні. Пептидний зв’язок існуючи на 90% в кетонній (транс-положення) та на 10% у енольній формах (таутомерія), здатен утворювати по два водневі зв’язки з полярними групами та з іншими пептидними зв’язками (зв’язки, що утворені проліном утворюють тільки один водневий зв’язок). Первинна структура білків є основою для самоорганізації цих молекул у просторі структури (рис. 3).
При вивченні первинної структури використовують як хімічні агенти, так і ферменти.
Протеолітичні ферменти. Це ферменти, що каталізують гідролітичний розрив пептидних зв'язків. Вони діляться на дві групи:
1) екзопептидази, які відщеплюють кінцеву амінокислоту, – амінопептидаза відділяє N-кінцеву амінокислоту, карбоксипептидаза відщеплює С-кінцеву амінокислоту;
2) ендопептидази, які діють на зв'язки між некінцевими амінокислотами. Ендопептидази володіють специфічністю відносно амінокислот, зв'язки яких гідролітично розриваються (з приєднанням елементів молекули води), – трипсин розриває молекулу на рівні карбоксилів лізину і аргініну; хімотрипсин розриває пептидні зв'язки тільки по карбоксилах ароматичних амінокислот: фенілаланіна, тирозина і триптофана.
Пепсин також є ендопептидазою, але його специфічність не цілком вивчена.

Рис. 3. Первинна структура білкової молекули
Визначення амінокислотного складу. Починають з повного гідролізу білка, тобто з розриву всіх пептидних зв'язків з приєднанням води і звільненням амінокислот. Гідроліз здійснюють дією 6N HCl при 110°C протягом 24 або 48 ч в запаяній під вакуумом ампулі (більш короткочасний гідроліз може виявитися неповним, при більш тривалому виникає небезпека руйнування невеликої частини амінокислот). Необхідно провести ще і лужний гідроліз невеликої кількості білка обробкою 2 – 4N NaOH для отримання триптофана, який при кислотному гідролізі руйнується. Отриману таким чином суміш амінокислот фракціонують і аналізують хроматографією на катіонообмінній смолі по описаному вище методу Мура і Стейна.
Визначення N-кінцевої амінокислоти. Для цієї мети можна використовувати різні методи (див. вище).
– метод Сенгера з динітрофторбензолом, ДНФБ.
– метод Едмана з використанням фенілізотіоціаната.
– дія амінопептидази.
Визначення С-кінцевої амінокислоти. Мається на увазі амінокислота, яка несе вільну COOH-групу і стоїть на кінці поліпептидного ланцюга. Її визначення досить важке (див. вище).
Визначення амінокислотної послідовності. Білок ділять на декілька зразків, які потім обробляють окремо. Один зразок, наприклад, гідролізують соляною кислотою на холоді, інший обробляють трипсином, третій хімотрипсином. Для кожного зразка одержують суміш пептидів різної довжини. Пептиди фракціонують методами електрофореза або хроматографії на іонообмінних смолах. Ці смоли схожі на ті, за допомогою яких фракціонують амінокислоти, але сітка полімеру в них менш тісна, що забезпечує проникання більш великих молекул всередину смоли і їх затримання.
Для кожного з поліпептидних фрагментів проводять обробку такого ж характеру, як для цілого білка, і якщо в результаті утворюються не дуже довгі пептиди, то вдається розшифрувати первинну структуру кожного з них, використовуючи, зокрема, метод Едмана. Потім встановлюють порядок взаємного розташування пептидів в молекулі білка. Цього досягають шляхом зіставлення пептидів, отриманих різними способами гідролізу, в яких амінокислотні послідовності частково перекриваються.
Метод „відбитків пальців” (фінгерпринт). Іноді виникає необхідність порівняти два близьких за своєю природою білка. Структура одного з них відома, і бажано визначити будову другого білка, не проводячи заново повного визначення його структури. В цьому випадку прагнуть вичленувати ті ділянки білків, які неідентичні. Для цього обидва білки спочатку піддають протеолізу, наприклад трипсином, а потім наносять в кут листа паперу гідролізат і проводять хроматографічне розділення в одному напрямі і електрофорез в перпендикулярному напрямі. Папір висушують і фарбують пептиди, що розділилися на площі листа. При цьому виявляють, що більшість плям розташована однаково, тобто, відповідає однаковим пептидам, і лише один або декілька пептидів – відмінні. Ці пептиди походять з тих частин молекул двох білків, які не ідентичні. Їх можна проаналізувати.
Цим методом Інгрему вдалося зіставити два гемоглобіни (білки, утворені поліпептидними ланцюгами двох типів, кожен з яких містить більше 140 амінокислот). Один з гемоглобінів був нормальним, а другий – виділений з крові хворого дрепаноцитозом (захворювання крові, відоме також під назвою серповидноклітинної анемії). Відмінність між двома гемоглобінами виявилася тільки в одному пептиді і була обумовлена заміною лише однієї амінокислоти.
Вторинна структура білка – це просторове розміщення первинної будови у вигляді a-спіралі або b-складчатої будови. Стабілізується вторинна структура численними водневими зв’язками між різними пептидними групами =C=O...H–N=. Спіральна конфігурація a-спіралі має гвинтову симетрію, водневі зв’язки утворюються між пептидними групами першим та четвертим амінокислотних залишків, причому бокові радикали не приймають участь у утворенні a-спіралі. Звичайно a-спіраль є у більшості білків, або ж як фрагмент молекули білка. b-складчаста структура зустрічається у структурних білків, частіше у білку містяться обидві структури.
Все темы данного раздела:
З історії розвитку біохімії
Біологічна хімія, або біохімія, – це наука про хімічний склад живих організмів і хімічні процеси, що забезпечують їх існування. Слово „біохімія” походить від двох грецьких слів: bi
НАПРЯМИ І МЕТОДИ ДОСЛІДЖЕННЯ В БІОХІМІЇ
Обмін речовин – основна ознака живого. Основною межею, що відрізняє живу матерію від неживих тіл, є обмін речовин. Ф. Енгельс, визначаючи життя, відзначав: „Життя є спосіб існуванн
ХІМІЧНИЙ СКЛАД ТВАРИННОГО ОРГАНІЗМУ
Хімічні елементи. З відомих 115 хімічних елементів в живих організмах було виявлено близько 70. Частина з них постійно знаходиться в тканинах всіх тваринних організмів, незалежно в
Таблиця 1.
Хімічний склад деяких органів і тканин, % (по С. M. Рапопорту)
Орган, тканина
Вода
Білки
Ліпіди
Мінераль
Таблиця 2.
Хімічний склад живої клітини (по О. Гізе)
Речовина
Вміст,
%
Середня молекулярна маса
Число молекул
на
БІОЛОГІЧНІ МЕМБРАНИ
Всі живі клітини відокремлені від навколишнього середовища поверхнею, яка називається клітинною мембраною. Крім того, для еукаріотів характерним є утворення усередині клітин декількох компартментів
Основні поняття і терміни біологічної хімії
Обмін речовин і енергії є однією з найважливіших і найсуттєвіших ознак живого організму. Живі організми – відкриті системи, для існування яких необхідний постійний двосторонній зв'язок (обмін) з на
Загальна характеристика, будова та функції вуглеводів
Вуглеводи – органічні сполуки, які найчастіше складаються з трьох хімічних елементів – вуглецю, водню і кисню. Відомі багато сполук, що містять, окрім цих трьох елементів, також фосфор, сірку і азо
А. Моносахариди
Моносахариди класифікують за наявністю альдегідної або кетонної групи (альдози і кетози), числом вуглецевих атомів (тріози, тетрози, пентози, гексози і т.д.) і за хімічною природою (нейтральні і ки
Б. Полісахариди
Складні вуглеводи ділять на олігосахариди і власне полісахариди. Олігосахариди – це вуглеводи, молекули яких містять від 2 до 10 залишків молекул моносахаридів. Найбільший інтерес представляють ди-
Загальна характеристика, будова та функції ліпідів
Ліпідами називають жири і жироподібні речовини. Містяться вони у всіх живих клітинах і виконують ряд життєво важливих функцій: структурну, метаболічну, енергетичну, захисну. При розкладанні багатьо
Фізичні і хімічні константи деяких жирів
Константи
Вид жиру
Яловичий
Баранячий
Свинячий
Густина при 15°С, г/см3
Білки. Амінокислоти
Білки – високомолекулярні органічні сполуки, азотовмісні нерегулярні біополімери, побудовані з великої кількості залишків амінокислот, сполучених пептидним та іншими видами зв’язків. Свою назву біл
Функції білків
Каталітична функція. Усі ферменти – біологічні каталізатори, що зумовлюють перебіг хімічних реакцій в організмі – мають білкову природу. Вони є необхідними для життєдіяльності кожного живого
Хімічний склад білків
Елементний склад. Дослідження елементного складу білків розпочалось ще на початку XIX ст. Перші дані про елементарний склад білків з’явились у 1809 р. на основі досліджень Ф. Грена. У резуль
Амінокислоти
У живих клітинах синтезується багато макромолекул (білків, нуклеїнових кислот, полісахаридів), які відіграють роль структурних компонентів, біокаталізаторів, гормонів, рецепторів або в них зосередж
Таблиця 1
L-a-амінокислоти, які входять до складу білків1)
№
Назва
Скорочене
позначення
Стру
Основана на полярності їх R–груп
Неполярні
Полярні
Аланін
Валін*
Ізолейцин*
Лейцин*
Метіонін*
Пролін
Триптофан*
Фенілаланін*
Аргінін**
Асп
Роль в метаболізмі організму
Назва
Роль
Структурна формула
Гідроксилізин
Входить до складу колагену та желатини
Властивості карбоксильної групи
Як і всі інші сполуки, що містять карбоксильну групу, амінокислоти при взаємодії з основами утворюють солі, а в результаті реакцій із спиртами і амінами утворюють, відповідно, ефіри
Властивості аміногрупи
Як і всі сполуки, що містять аміногрупу, амінокислоти взаємодіють з кислотами, утворюючи солі.
Відділення аміногрупи від амінокислоти може бути здійснено багатьма способами
Методи визначення N-кінцевих амінокислот
Реакція з динітрофторбензолом (реакція Сенгера). Динітрофторбензол реагує з аміногрупою амінокислоти і, звільняючи фтористоводневу кислоту, утворює динітрофеніламінокислоту (ДНФ-ак
Характеристика конформацій поліпептидів
Спіральна структура. Модель просторової конфігурації поліпептидного ланцюга у вигляді спіралі вперше запропонували Л. Полінг і Р. Корі в 1951 p. на основі даних рентгеноструктурного аналізу
Фізико-хімічні властивості білків
Розчинність. Більшість білків розчинна у воді і у водних розчинах. Розчинність залежить від будови молекул білка і іонного складу середовища, зокрема від іонної сили і рН.
Іонна
Визначення молекулярної маси білків
Молекулярна маса білків велика, і для їх визначення часто доводиться використовувати зовсім інші методи, ніж в органічній хімії.
Осмотичний тиск. Якщо речовина, розчинена у воді, ві
Класифікація білків
Для класифікації білків часто використовують функціональний принцип, тобто їх класифікують виходячи з основних функцій, які вони виконують під час метаболізму. За цим принципом білки поділяють на т
Хімічний склад і будова нуклеїнових кислот
Нуклеїнові кислоти, як і білки, є високомолекулярними сполуками. Вони побудовані з великої кількості структурних одиниць, які називаються нуклеотидами, тобто нуклеїнові кислоти – полінуклеотиди.
Компоненти нуклеїнових кислот і їх позначення
Азотиста основа
Нуклеозид
Рибонуклеотидфосфат
Дезоксирибонуклеотидфосфат
моно-
ди-
три-
Будова нуклеїнових кислот
Окремі нуклеотиди, які побудовані з пуринових або піримідинових основ, рибози або дезоксирибози і залишку фосфорної кислоти, сполучаючись між собою, утворюють ди-, три-, тетра-, пента- гекса- і пол
Властивості нуклеїнових кислот
Нуклеїнові кислоти – це речовини білого кольору, волокнистої будови, погано розчинні у воді. їх солі (лужних металів) добре розчинні у воді. Нуклеїнові кислоти розчиняються також у розчинах солей:
Функції нуклеїнових кислот
Нуклеїнові кислоти в організмі виконують різноманітні функції, але найважливішими серед них є участь у передачі спадкових ознак і процесах біосинтезу білка. Основними носіями генетичної інформації
Загальні відомості
Вітаміни були відкриті в 1880 р. російським лікарем М.І. Луніним (1853 – 1937) в експериментах на двох групах білих мишей. Тваринам першої групи він давав штучний раціон (вода + казеїн + лактоза +
Жиророзчинні вітаміни
Жиророзчинні вітаміни не розчиняються у воді, але розчиняються в органічних розчинниках, термостабільні, стійкі до зміни рН середовища, можуть частково депонуватися в тканинах людського і тваринног
Водорозчинні вітаміни
Водорозчинні вітаміни не розчиняються в жирах і багатьох органічних розчинниках, але добре розчиняються у воді, термолабільні, не стійкі до змін рН, не можуть депонуватися в тканинах. Є складовими
Вітаміноподібні речовини
Інозит. Інозит (мезоінозит) широко поширений в тваринному і рослинному світі. Необхідний людині і багатьом тваринам.
Гіпо- і авітамінози. У
Коротка історія вчення про ферменти
Ферменти (ензими) – це біологічні каталізатори білкової природи, які утворюються в живих клітинах і володіють здатністю прискорювати хімічні процеси в організмі. І.П. Павлов назвав
Біосинтез і клітинна локалізація ферментів
Ферменти за хімічною природою є простими або складними білками. Для їх утворення відповідні клітини повинні містити амінокислоти та інші речовини, з яких утворюються простетичні групи або кофермент
Методи виділення і очищення ферментів
Вихідним матеріалом для отримання різних ферментів найчастіше служать органи і тканини тварин і рослин, травні соки, а також клітинна маса мікроорганізмів. Підбираючи матеріал, слід враховувати вид
Загальні властивості ферментів
Білкова природа ферментів. Білкова природа ферментів в даний час повністю встановлена. Всі ферменти є простими або складними білками. Наприклад, до простих білків відносяться. ферм
Оптимальні значення рН для деяких ферментів
(зa T.T. Березовим і Б.Ф. Коровкіним)
Фермент
рН
Фермент
рН
Пепсин
1,
Катіони металів, які активують деякі ферменти
(за T.T. Березовим і Б.Ф. Коровкіним)
Фермент
Катіон металу
Фермент
Катіон металу
Хімічна природа ферментів
Відомо, що ферменти мають білкову природу. Як і білки, їх ділять на прості і складні. Прості ферменти є однокомпонентними, а складні – дво- і багатокомпонентними.
Для ферментів-білків хара
Коферменти. Простетичні групи
Коферментами називають низькомолекулярні органічні сполуки небілкової природи, що володіють здатністю оборотно зв’язуватися з ферментним білком. Їх можна відділити від апофермента діалізом, дією ки
Зоферменти
Ізоферменти – це різновиди ферменту, які володіють однією і тією ж субстратною специфічністю, але відрізняються між собою деякими фізичними, хімічними, каталітичними та імунологічними властивостями
Механізм дії ферментів
Механізм ферментативного каталізу є об’єктом дослідження багатьох учених. При ферментативному каталізі виявляється білкова природа ферментів, їх термолабільність, вплив рН середовища, специфічність
Номенклатура і класифікація ферментів
У даний час відомо понад 1000 ферментів. У міру розвитку біохімії виникала необхідність у вдосконаленні номенклатури і класифікації ферментів. До перших ферментів, відкритих біохіміками, відносятьс
Оксидоредуктази
Ферменти, які каталізують окисно-відновні процеси. Оксидоредуктази – двокомпонентні ферменти. Функції кофакторів у яких можуть виконувати піридин– (НАД і НАДФ) і флавіннуклеотиди (ФМН і ФАД), заліз
Трансферази
Трансферази – клас ферментів, які каталізують перенесення різних хімічних груп від однієї органічної сполуки (донатора) до іншої (акцептору). Вони беруть участь в обміні нуклеїнових кислот, білків,
Гідролази
Це ферменти, що каталізують реакції розщеплення (іноді і синтезу) органічних речовин, за участю води:
R1R2 + HOH « R1H + R2OH
Гідролази
Зомерази
Ці ферменти каталізують реакції внутрішньомолекулярного переміщення різних груп органічних речовин. Складаються з п’яти підкласів.
5.1. Рацемази і епімерази. Каталізують р
Взаємозв’язок між ферментами
Обмін речовин в організмі каталізується поліферментними системами, в які входять ферменти, що належать до всіх шести класів. Між ферментами існує взаємозв’язок, спадкоємність і послідовність. Для н
Ферменти в народному господарстві, медицині, ветеринарії і зоотехнії
Ферменти широко використовуються в народному господарстві. Так, в хлібопеченні застосовують ферментативні препарати, які покращують якість і аромат хліба. Дозрівання тіста прискорюється на 30%, а в
Загальна характеристика гормонів
Гормони – це біологічно активні речовини, які синтезуються залозами внутрішньої секреції і виділяються безпосередньо в кров, лімфу або ліквор. Наука про залози внутрішньої секреції
Гормони гіпоталамуса
Гіпоталамус здійснює зв'язок між центральною нервовою системою і залозами внутрішньої секреції. 32 пари ядер гіпоталамуса беруть участь в регуляції функцій і обміну речовин організму. Регуляція зді
Гормони гіпофіза
Гіпофіз – найважливіша залоза внутрішньої секреції. Разом з гіпоталамусом утворює єдину морфофізіологічну систему, яка регулює різні сторони обміну речовин. Гіпофіз складається з трьох частин: пере
Гормони епіфіза
Епіфіз – це невелика залоза внутрішньої секреції, вона розміщена між мозочком і півкулями головного мозку. Основу епіфіза складають пінеальні і гліальні клітини. Тут синтезується декілька гормонів:
Гормони щитовидної залози
Щитовидна залоза – найважливіший орган внутрішньої секреції. У різних тварин її розміри досягають 6 – 7 см, маса – 15 – 42 г. Швидкість кровотоку в щитовидній залозі в 100 разів більша, ніж у тазов
Гормон паращитовидної залози
Паращитовидні залози – невеликі епітеліальні утворення, розташовані у вигляді однієї – двох пар на поверхні щитовидної залози. Виробляють гормон, який є одним з основних регуляторів обміну кальцію
Гормон навколовушної залози
Навколовушна залоза – найбільша або друга після підшлункової залози по величині залоза. У жуйних секретує безперервно. Навколовушна залоза виробляє гормон паротин.
Хімічна п
Гормон вилочкової залози
Вилочкова залоза (тимус) – лімфоепітеліальний орган. Розвивається в ранньому віці, у дорослих тварин редукується. Залоза складається з кіркової і мозкової речовини. В мозковій речовині в шаруватих
Гормони підшлункової залози
Підшлункова залоза виконує секреторні і інкреторні функції. Її гормонами є: інсулін, глюкагон, ліпокаїн і ваготонін. Гормони виробляються в основному в клітинах острівців Лангерганса, які складають
Чоловічі статеві гормони
Чоловічі статеві гормони – андрогени синтезуються в основному в сім’яниках, деяка частина – в яєчниках і корі наднирників. Найбільша кількість гормонів міститься в спермі. Сперма на 90 – 98% склада
Жіночі статеві гормони
Жіночі статеві гормони синтезуються в яєчниках, плаценті і частково в наднирниках. Відрізняються між собою за хімічною будовою, властивостями і значенням.
Хімічна природа.
Гормони кори наднирників
Наднирники – парні залози внутрішньої секреції. Кожний наднирник складається з кіркової і мозкової речовини. Кіркова речовина складає 60 – 70% загальної маси органу. Експериментальне видалення орга
Гормони мозкової речовини наднирників
Мозкова речовина наднирників складає 30 – 40% його загальної маси. Продукує гормони адреналін і норадреналін. Вивчення гормонів почалося після дослідів Н. Цибульського і Л. Шимановича в 1895 р., як
Гормоноїди
Гормоноїди, або парагормони, – це різнорідні за хімічною будовою речовини, які проявляють сильну біологічну дію на багато фізіологічних процесів в організмі. На відміну від гормонів їх біосинтез не
Загальні уявлення про обмін речовин і енергії
Обмін речовин і енергії є однією з найважливіших і найсуттєвіших ознак живого організму. Живі організми – відкриті системи, для існування яких необхідний постійний двосторонній зв'язок (обмін) з на
Енергетичний баланс організму. Макроергічні сполуки
Обмін речовин в організмі тісно пов’язаний з обміном енергії. Постійне надходження та використання енергії є необхідною умовою існування живих організмів як відкритих систем. За рахунок надходження
Біологічне окислення
Вивчення процесів окислення було започатковано M.В. Ломоносовим та А. Лавуазьє на основі дослідження продуктів згорання. А. Лавуазьє, співставляючи процеси горіння з процесами дихання в живих орган
Таблиця 1
Стандартні потенціали деяких окисно-відновних систем
Система
Е’0, вольт
Кисень / вода
+ 0,82
Окислювальне фосфорилювання
Розглянуті вище реакції окислення – відновлення різних субстратів, що здійснюються в живих організмах у процесі внутрішньоклітинного обміну, дістали назву біологічного окислення. Процеси біологічно
Перетравлювання вуглеводів
Вуглеводи складають основу рослинних кормів. У більшості з них вони знаходяться у вигляді оліго-, гомо- і гетерополісахаридів, складових частин глюко- і мукопротеїдів, нуклеїнових кислот, біокомпле
Всмоктування вуглеводів
Всмоктування – це складний біохімічний процес переходу молекул моносахаридів і їх ефірів через епітелій слизової оболонки тонкої кишки в кров і лімфу. Слід зазначити, що деяка кількість моносахарид
Проміжний обмін
Він протікає в органах, тканинах, клітинах та інтрацелюлярних структурах. При цьому моносахариди крові використовуються для різних потреб організму – енергетичних, пластичних, захисних та ін. Так,
Вміст цукру в крові людини і деяких тварин
Об'єкт дослідження
Вміст цукру,
ммоль/л
Об'єкт дослідження
Вміст цукру, ммоль/л
Ссавці
Синтез глікогену
Глікоген як джерело хімічної енергії і регулятор осмотичного тиску крові має велике значення для організму. В органах відкладається у вигляді зерен.
Вміст глікогену в печінці людини і твар
Розпад глікогену
Глікоген – лабільна сполука. Протягом доби в організмі людини і тварин синтезується і розщеплюється 65 – 70% глікогену печінки.
Зменшення вмісту цукру в крові рефлекторно призводить до роз
Анаеробне розщеплення вуглеводів
Цей процес протікає в органах, тканинах і клітинах живого організму без участі кисню. Його основні реакції схожі з хімізмом спиртового бродіння, названого Л. Пастером „життям без ки
Спиртове бродіння
У нижчих організмів – дріжджових і цвілевих грибів, деяких мікроорганізмів – процес анаеробного перетворення вуглеводів завершується утворенням етилового спирту, тому він дістав наз
Аеробне перетворення вуглеводів
Аеробне й анаеробне перетворення вуглеводів тісно зв'язані між собою. Це насамперед виявляється в тому, що обидва процеси проходять однаково включно до стадії утворення піровиноград
Пентозний цикл
Пентозний цикл – це ланцюг послідовних хімічних перетворень вуглеводів, у результаті якого в тканинах і клітинах звільняється хімічна енергія і утворюються пентози, необхідні для си
Глюкозо-6-фосфат + 7Н2О + 12НАДФ+ ® 6СО2 + 12НАДФ×Н2 + 5 Глюкозо-6-фосфат + H3PO4.
Отже, виходячи із сумарного рівняння бачимо, що при повному окисленні 1 молекули глюкози утворюється 12 молекул відновленого НАДФ, які в процесі окислення у мітохондріях можуть дати
Біосинтез дисахаридів
Важливими представниками дисахаридів є сахароза, лактоза, мальтоза та деякі інші. Біосинтез їх здійснюється в основному за реакціями трансглікозування. При цьому процес перенесення
Регуляція вуглеводного обміну
У регуляції вуглеводного обміну беруть участь нервова система, залози внутрішньої секреції, печінка і деякі вітаміни. Центри, які регулють вуглеводний обмін, розміщені в корі великих півкуль, промі
Патологія вуглеводного обміну
Причинами патології вуглеводного обміну можуть бути багато інфекційних, інвазивних і незаразних хвороб. Патологія вуглеводного обміну найчастіше виявляється у вигляді гіперглікемії і глюкозурії, ац
Біологічна роль ліпідів в організмі
Ліпіди, як і білки, вуглеводи та інші речовини, відіграють в організмі важливу біологічну роль. Вона насамперед визначається тим, що ці речовини характеризуються комплексом своєрідних фізико-хімічн
Трудової діяльності
Вид діяльності
Жир
тваринний
рослинний
Розумова праця:
чоловіки
Перетравлювання ліпідів
Більшість ліпідів засвоюється організмом тільки після попереднього розщеплення. Під впливом травних соків вони гідролізуються до простих сполук (гліцерину, вищих жирних кислот, стеринів, гліколів,
Всмоктування ліпідів
Більшість ліпідів всмоктується в нижній частині дванадцятипалої і у верхній частині тонкої кишки, інші – в інших ділянках тонкої кишки. Продукти розщеплення ліпідів всмоктуються епітелієм ворсинок.
Проміжний обмін
Обмін ліпідів тісно пов'язаний з обміном вуглеводів, білків, мінеральних сполук і вітамінів, оскільки вони мають багато загальних продуктів метаболізму, що зв'язують обмін речовин в єдине ціле. Про
Біосинтез ліпідів
Біосинтез різних груп ліпідів має свої особливості.
Біосинтез жирів. Біосинтез жирів складається з трьох основних етапів: синтез гліцерину, вищих жирних кислот і сполученн
Ліполіз
Ліполізом називається процес ферментативного розщеплення ліпідів тканин і клітин до їх складових частин, які використовуються для задоволення різних потреб організму — енергетичних, пластичних та і
Кінцевий обмін
Основними кінцевими продуктами ліпідного обміну є дві речовини – вуглекислий газ і вода. Вони виділяються легенями, нирками, товстою кишкою, пітними залозами. Вода виділяється переважно у складі се
Регуляція ліпідного обміну
Процеси обміну ліпідів регулюються нейрогуморальним шляхом. Центральна нервова система впливає на ліпідний обмін безпосередньо або через залози внутрішньої секреції. Відповідні ділянки кори великих
Патології ліпідного обміну
Ліпідний обмін порушується при багатьох інфекційних, інвазивних і незаразних хворобах. Часто причиною порушення обміну є неправильно складені раціони. Патологія ліпідного обміну спостерігається при
Перетравлювання білків
У харчовому каналі білки піддаються розщепленню до амінокислот, які потім засвоюються організмом.
У ротовій порожнині їжа, що містить білки, механічно подрібнюється, змочується слиною і пе
Всмоктування білків
Білки всмоктуються у вигляді амінокислот, низькомолекулярних пептидів (частково) і складових частин простетичних груп. У новонароджених всмоктується частина нерозщеплених білків молозива і молока.
Проміжний обмін
Продукти всмоктування білків через систему ворітної вени поступають у печінку. Амінокислоти, що залишилися в крові після проходження через печінку, з печінкової вени потрапляють у велике коло крово
Кінцевий обмін
Під час проміжного обміну утворюється ряд хімічних сполук, які виділяються з організму як продукти розпаду білків. Зокрема, вуглекислий газ, що утворився, виділяється легенями, вода – нирками, пото
Регуляція білкового обміну
Всі етапи білкового обміну регулюються центральною нервовою системою та залозами внутрішньої секреції. Особливе місце в регуляції належить корі великих півкуль головного мозку і підкоровим центрам.
Патології білкового обміну
Обмін білків порушується при багатьох інфекційних, інвазивних і незаразних хворобах. Часто причиною порушень білкового обміну є неправильно складений раціон, недотримання режиму прийому їжі та ін.
Перетравлювання та всмоктування нуклеїнових кислот
Нуклеїнові кислоти в їжі та кормах знаходяться в основному у вигляді нуклеопротеїдів.
У ротовій порожнині їжа, що містить нуклеопротеїди, механічно подрібнюється, змочуються слиною і у виг
Проміжний обмін нуклеїнових кислот
Біосинтез нуклеїнових кислот
Матеріалом для синтезу нуклеїнових кислот у клітинах можуть бути екзогенні продукти гідролітичного розщеплення ДНК і РНК їжі. Частину матеріалів для цих
Кінцевий обмін нуклеїнових кислот
Пуринові і піримідинові основи, що утворилися в тканинах при розщепленні нуклеїнових кислот, отруйні і знешкоджуються в печінці (в меншій мірі – в слизовій оболонці кишок, селезінці та інших органа
Регуляція нуклеїнового обміну
Нуклеїновий обмін регулюється на різних рівнях, починаючи від цілого організму і закінчуючи молекулою нуклеїнової кислоти. Провідне місце належить центральній нервовій системі і її вищому відділу –
Патологія нуклеїнового обміну
Порушення нуклеїнового обміну різні. Найхарактернішою з них є подагра. Її причиною є порушення нейрогуморальної регуляції нуклеїнового обміну. В суглобах, хрящах, сухожильних піхвах і слизов
Значення і розподіл води в організмі
Вода складає близько 3Д біомаси Землі. Перші живі організми виникли у водному середовищі. Життя без води неможливе. Собака, позбавлена корму, може прожити до 100 діб, без води
Обмін води
Тканини і клітини використовують два види води: екзо- і ендогенну. Екзогенна вода поступає в організм ззовні. В загальній масі вона складає 6/7 всієї води, необхідної д
Загальна характеристика мінеральних речовин
У живих організмах виявлено близько 70-ти хімічних елементів, із них 47 присутні в ньому постійно. Це біогенні хімічні елементи.
За кількісним вмістом у живій матерії всі
Обмін мінеральних речовин
Мінеральні речовини, що входять до складу раціону, в організмі піддаються складним перетворенням. Так, основну масу мінеральних речовин, що знаходяться у вільному стані, організм засвоює без якої-н
Мг% на сиру тканину
Орган або тканина
К
Na
Ca
Mg
Cl
P
М'язи
Макроелементи
Чотири макроелементи складають органічну основу живих організмів. Це кисень (62,43%), вуглець (21,15%), водень (9,86%) і азот (3,10%). Решту макроелементів прийнято вважати мінераль
Мікроелементи
Йод. В організмі йоду міститься до 0,027% загальної маси. Йод необхідний для синтезу гормонів щитовидної залози. В організм йод поступає з кормом, водою і повітрям. Всмоктується в шлунку
Регуляція на рівні мембрани
У дослідженнях на бактеріях вдалося точно охарактеризувати механізми, що забезпечують активне і специфічне проникнення в клітину деяких метаболітів завдяки участі в них білків пермеаз, які перенося
Метаболічний рівень регуляції
Метаболічний рівень регуляції забезпечує узгодженість процесів обміну за рахунок зміни концентрації метаболітів. Метаболіти – це низькомолекулярні сполуки, які потрапляють в організм з продуктами х
Оперонний рівень регуляції
Даний рівень регуляції процесів життєдіяльності забезпечується на рівні оперона. Оперон – ділянка ДНК, обмежена промотором і термінатором, яка знаходиться під регуляторною дією гена-регулятора і за
Клітинний рівень регуляції
Якщо врахувати, що клітина є основною структурною одиницею живих організмів, то інтенсивність перебігу обмінних процесів у ній відіграє вирішальну роль у забезпеченні процесів життєдіяльності. Меха
Організменний і популяційний рівні регуляції
Організменний рівень регуляції забезпечується за рахунок складних механізмів, для здійснення яких необхідна наявність спеціальних диференційованих клітин і систем, що виявляють контрольну функцію (
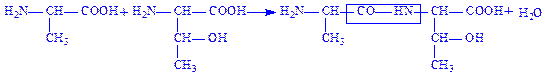















Новости и инфо для студентов