рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Будова нуклеїнових кислот
Реферат Курсовая Конспект
Будова нуклеїнових кислот
Будова нуклеїнових кислот - раздел Химия, З історії розвитку біохімії Окремі Нуклеотиди, Які Побудовані З Пуринових Або Піримідинових Основ, Рибози...
Окремі нуклеотиди, які побудовані з пуринових або піримідинових основ, рибози або дезоксирибози і залишку фосфорної кислоти, сполучаючись між собою, утворюють ди-, три-, тетра-, пента- гекса- і полінуклеотиди, тобто нуклеїнові кислоти. До складу нуклеїнових кислот входять сотні і тисячі окремих нуклеотидів. Вони з'єднані між собою за допомогою фосфоефірного зв'язку, який утворюється внаслідок взаємодії гідроксильної групи, що знаходиться біля 3'-го атома вуглецю пентози одного нуклеотиду з залишком фосфорної кислоти, який знаходиться біля 5'-го атома вуглецю пентози наступного нуклеотиду.
На кінцях полінуклеотидного ланцюга знаходяться пентози. Один ланцюг містить вільну групу ОН в положенні 3¢ а другий – фосфорильовану групу ОН в положенні 5¢. Початок ланцюга позначається фосфатом при 5'-вуглеці пентози, а кінець ланцюга – гідроксильною групою при 3'-вуглеці пентози. Скорочено напрямок ланцюга позначається 5'®3¢.
Нуклеїнові кислоти залежно від хімічного складу, структури і біологічної ролі поділяють на дві групи: рибонуклеїнові кислоті (РНК) і дезоксирибонуклеїнові кислоти (ДНК).
Рибонуклеїнові кислоти побудовані з рибонуклеотидів, які крім залишку фосфорної кислоти містять вуглеводний компонент (рибозу) і азотисті основи (аденін, гуанін, урацил і цитозин).
До складу дезоксирибонуклеотидів входять нуклеотиди, у яких вуглеводний компонент не рибоза, а дезоксирибоза та азотисті основи – аденін, гуанін, цитозин і замість урацилу – тимін.
Отже, РНК і ДНК відрізняються між собою за хімічним складом тим, що перша містить рибозу і урацил, а друга – дезоксирибозу і тимін. Нижче подано будову фрагментів полінуклеотидних ланцюгів РНК і ДНК (рис. 1).

Рис. 1. Фрагменти ланцюгів нуклеїнових кислот
Дезоксирибонуклеїнові кислоти (ДНК)
ДНК є основним генетичним матеріалом живих систем. У організмах, за винятком вірусів і бактерій, вона сконцентрована в ядрах клітин. Невелика кількість ДНК міститься в мітохондріях, хлоропластах та в деяких інших включеннях клітин.
Характерною ознакою ДНК є висока її молекулярна маса. Вона коливається в досить широких межах і залежить насамперед від того, з якого організму виділена. Зараз найкраще вивчена молекулярна маса ДНК вірусів і фагів. Вона вимірюється десятками і сотнями мільйонів. Так, молекулярна маса бактеріофагу Фd становить 1,9 млн., аденовірусу – 21 млн., а бактеріофагу Т4 – 111 – 131 млн. Молекулярна маса ДНК еукаріот, очевидно, ще вища. Про це може свідчити молекулярна ДНК плодової мушки дрозофіли, яка становить 40 ´109.
Для ДНК, як і для білків, властиві кілька рівнів структур: первинна, вторинна і третинна.
Первинна структура – це порядок (певна послідовність) розміщення мононуклеотидів у полінуклеотидних ланцюгах ДНК. Вивчення цієї структури становить певні труднощі, оскільки різні види ДНК побудовані з великої кількості мононуклеотидів – сотень і навіть тисяч. Крім того, послідовність розміщення чотирьох різних мононуклеотидів у полінуклеотидних ланцюгах різних видів ДНК неоднакова. Унікальність кожної ДНК визначається саме послідовністю розміщення мононуклеотидів в її молекулі. Виходячи з цього, дослідження первинної структури ДНК якісного складу, кількісного вмісту та порядку чергування мононуклеотидних ланок у полінуклеотидних ланцюгах є досить важливою проблемою, над вирішенням якої працювали вчені різних країн, починаючи з початку XX ст.
Тривалий час первинну структуру ДНК вивчали на основі другорядних даних: локалізації пуринових і піримідинових блоків, фізико-хімічних властивостей, розподілу мінорних основ тощо. Переломним етапом у цих дослідженнях стало впровадження та вдосконалення нових методів, таких як електрофорез у поліакриламідному гелі, рентгеноструктурний аналіз, радіоавтографія та відкриття ферментів рестриктаз. Дані ферменти мають точно визначену субстратну специфічність і можуть здійснювати секвенування полінуклеотидних ланцюгів за місцем локалізації певних мононуклеотидів пуринового та піримідинового ряду з утворенням фрагментів з відомими кінцевими послідовностями мононуклеотидів (залежно від виду рестриктаз). Утворені фрагменти, завдяки наявності в них негативного заряду (за рахунок дисоційованих фосфатних груп), розділяють методом електрофорезу в поліакриламідному гелі. Даний метод виявився досить чутливим і дає змогу розділяти фрагменти ДНК, які відрізняються за довжиною на одну мононуклеотидну ланку.
Чергування мононуклеотидних ланок в утворених коротких фрагментах ДНК визначають за допомогою методів, в яких використовують радіоактивний фосфор (Р32) та секвенацію за участю хімічних реагентів (дифенілсульфату, гідразину тощо), які забезпечують розривання міжнуклеотидних зв'язків за місцем локалізації одного з чотирьох нуклеозидмонофосфатів (А, Т, Г, Ц). Потім зразки розділяють методом гель-електрофорезу. За даними радіоавтограм, електрофореграм визначають первинну структуру коротких фрагментів ДНК. Чергування мононуклеотидів у всій молекулі ДНК визначають по перекриванню послідовностей мононуклеотидів, добутих внаслідок використання рестриктаз, що мають різну субстратну специфічність.
Даний метод вивчення первинної структури ДНК було розроблено в другій половині 70-х років. Він дістав назву методу секвенування Свердлова-Максама-Гілберта. Дещо раніше (1975 р.) В. Гілберт запропонував метод вивчення первинної структури ДНК на основі одержання РНК-вих копій певних її ділянок за участю ферменту РНК-полімерази з наступним розшифруванням їхньої структури. Застосування цих методів дало змогу розшифрувати первинну структуру ДНК різних організмів: вірусу SV-40, бактеріофагів yХ-174, а також окремих ділянок ДНК-еукаріот – гена гормону соматостатину, гена тирозинової тРНК, гена g-глобуліну людини тощо. Нині вчені багатьох країн світу працюють над програмою „геном людини”, метою якого є розшифрування первинної структури всієї ДНК організму – геному (сукупності генів, у яких закодована генетична інформація).
При вивченні первинної структури ДНК певний інтерес становило дослідження щодо співвідношення окремих нуклеотидів у полінуклеотидних ланцюгах. Американським ученим Е. Чаргаффом та його співробітниками було виконано комплекс досліджень і на основі добутих даних виведено ряд важливих правил, які дістали назву правил Чаргаффа:
1. Сума пуринових нуклеотидів дорівнює сумі піримідинових нуклеотидів:
(Пур = Пір, або 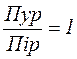 ).
).
2. Молярний вміст аденіну (А) дорівнює молярному вмісту тиміну (Т):
(А = Т, або  ).
).
3. Молярний вміст гуаніну (Г) дорівнює молярному вмісту цитозину (Ц):
(Г = Ц, або 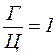 ).
).
4. Відношення суми молярних концентрацій Г і Ц до суми молярних концентрацій А і Т у різних видів ДНК відрізняється між собою.
5. В одних видах ДНК, зокрема виділених з організму тварин, вищих рослин і багатьох мікроорганізмів, нуклеотиди, що містять аденін і тимін, переважають над нуклеотидами, що містять гуанін і цитозин (А + Т > Г + Ц). Такі дезоксирибонуклеїнові кислоти називаються ДНК АТ-типу.
В інших ДНК, виділених із мікроорганізмів і бактерій, нуклеотиди, які містять гуанін і цитозин, переважають над нуклеотидами, які містять аденін і тимін (Г + Ц > А + Т). Такі ДНК утворюють ГЦ-тип дезоксирибонуклеїнових кислот.
У природі переважають ДНК АТ-типу.
Значний внесок у вивчення хімічного складу нуклеїнових кислот зробили також академіки А.М. Білозерський і О.С. Спірін. Одержані ними дані дали змогу виявити видову специфічність ДНК у рослин і тварин.
Вивчення нуклеотидного складу ДНК різних організмів показало, що він коливається у мікроорганізмів, водоростей, грибів і особливо у бактерій. Специфічний склад ДНК у них настільки виражений, що може бути однією з надійних систематичних ознак. Нуклеотидний склад ДНК у тварин і вищих рослин, на відміну від мікроорганізмів, коливається в значно менших межах. Так, якщо у бактерій коефіцієнт специфічності ДНК, тобто відношення  , змінюється від 0,45 до 2,8 (у 6 разів), то у вищих рослин і різних видів тварин він становить 0,54 – 0,94 (змінюється лише в 2 рази).
, змінюється від 0,45 до 2,8 (у 6 разів), то у вищих рослин і різних видів тварин він становить 0,54 – 0,94 (змінюється лише в 2 рази).
При вивченні первинної структури ДНК прокаріот і еукаріот були встановлені закономірності, які стосуються чергування мононуклеотидів у полінуклеотидннх ланцюгах.
ДНК прокаріот:
1. У молекулах ДНК, виділених з бактеріофагів, майже всі послідовності нуклеозидмонофосфатів унікальні (зустрічаються лише один раз). Вони несуть інформацію про первинну структуру іРНК і виконують роль матриць під час синтезу білків з суворо генетично детермінованою первинною структурою.
2. У молекулах ДНК бактерій унікальні послідовності мононуклеотидів перериваються послідовностями, що повторюються. Так, у геномі Е. соlі зустрічається шість ідентичних ділянок, які кодують рибосомальні РНК (рРНК).
3. Серед коротких послідовностей, що повторюються в хромосомах бактерій, знаходяться IS-елементи (мігруючі елементи ДНК).
Деякі характерні особливості та закономірності нуклеотидного складу було встановлено і для ДНК еукаріот. Так, на структурі ДНК еукаріот виявлено кілька видів послідовностей нуклеозидмонофосфатів.
ДНК еукаріот:
1. Послідовності, які складають 64 % геному і включають ділянки ДНК, що містять структурні гени або цистрони. Вони несуть інформацію про синтез молекул іРНК.
2. Послідовності, що повторюються і кодують переважно тРНК та сполуки, що необхідні організму в значних кількостях. Дані послідовності утворюють так звані тандемні повтори.
3. Послідовності, що часто повторюються (сотні тисяч і мільйони разів). Вони складають так звану сателітну ДНК (від лат. satelles – супутник). Таку назву вона дістала в зв'язку з тим, що її можна відділити методом центрифугування в градієнті концентрацій хлориду цезію.
Сателітна ДНК мишей містить послідовності 5'–АААААГГАА–3" 3¢–ТГТТТАЦГ–5", які повторюються більше 300 разів. Особливістю сателітних ДНК є наявність в їхньому складі чергування комбінацій з трьох, а не чотирьох нуклеозидмонофосфатів.
У людини виявлено чотири сателітні ДНК, які становлять 4% хромосомної ДНК. Сателіти, як правило, знаходяться в центромерному гетерохроматині і беруть участь у спарюванні та розходженні хромосом.
4. Зворотні повтори – паліндроми (від грец. Palindromos – перевертень, той, що вертається). Паліндроми – послідовності мононуклеотидів, що повторюються в зворотньому порядку. При цьому послідовності нуклеозидмонофосфатів в одному з ланцюгів паліндрому співпадають з послідовностями нуклеозидмонофосфатів у другому ланцюгу, якщо зчитувати його в протилежному напрямку:
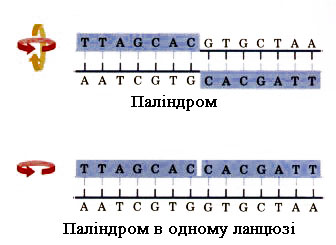
Паліндроми, як правило, мають різну довжину. Вони не впливають на формування вторинної структури, однак при формуванні вищих рівнів структури довгі паліндроми можуть утворювати хрестоподібні структури (а і б), які відіграють певну роль у розпізнаванні окремих ділянок ДНК відповідними ферментами та білковими факторами, що забезпечують регуляцію діяльності генів:
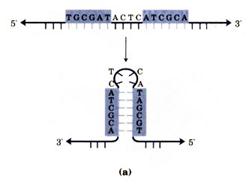

Дослідження первинної структури ДНК є досить важливим тому, що властивості і функції ДНК зумовлені послідовністю чергування мононуклеотидних залишків у полінуклеотидному ланцюгу. Основною біологічною функцією ДНК є збереження генетичної інформації. Оскільки у прокаріот уся ДНК хромосоми використовується для кодування структури іРНК, що виконує роль матриці при синтезі білків з специфічною структурою, генетична інформація на структурі ДНК прокаріот, локалізована на певних ділянках, дістала назву оперону (від лат. ореrоn – працюю, дію).
Оперон – ділянка ДНК, обмежена промотором і термінатором, яка містить цистрони або структурні гени (кодують первинну структуру іРНК, які забезпечують синтез білків-ферментів одного метаболічного циклу) і знаходиться під регуляторним впливом гена-регулятора. У прокаріот відомі оперони, до складу яких входить кілька структурних генів або цистронів, що кодують структуру ферментів одного метаболічного ланцюга (поліцистронні іРНК).
Оперон складається з промотора, гена-оператора, структурних генів, або цистронів, та гена-термінатора. Промотор – місце початку транскрипції, є короткою послідовністю мононуклеотидів ДНК, з якою зв'язується фермент ДНК-залежна–РНК-полімераза. Ген-оператор – це ділянка ДНК, що безпосередньо прилягає до структурних генів і регулює їхню функціональну активність за участю білка репресора, синтез якого кодується геном-регулятором. Ген-регулятор може знаходитись поряд чи на певній відстані від оперона. Завершується оперон геном-термінатором, який сигналізує про закінчення транскрипції (рис. 2).
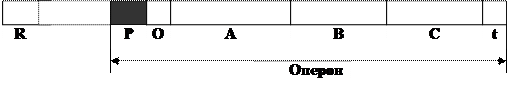
Рис. 2. Будова оперону (транскриптону) прокаріот: R – ген-регулятор; P – промотор; O – оператор; A, B, C – структурні гени; t – термінатор.
Для ДНК еукаріот характерним є те, що лише 2 % її є носієм генетичної інформації, решта виконує регуляторні та інші функції, тобто, на відміну від прокаріот, немає суворої відповідності первинної структури ДНК і первинної структури закодованих на ній білків тому, що порушено принцип колінеарності (відповідності – первинної структури ДНК, первинної структури білка). В зв'язку з цим поняття оперон для еукаріот має відносне значення, оскільки гени, що детермінують структуру ферментів одного метаболічного циклу, не обов'язково розміщені поряд і можуть бути локалізовані на різних ділянках ДНК і навіть різних хромосомах.
На структурі оперона еукаріот інформативні ділянки – екзони – чергуються з неінформативними – інтронами:

Для структурних генів еукаріот характерними є не поодинокі регуляторні ділянки, а цілі їх серії; відрізняються також ферментні системи, що забезпечують зчитування інформації та модифікацію продуктів транскрипції.
Значних успіхів у з'ясуванні первинної структури ДНК досягнуто в останні десятиріччя. Використання різних методів дослідження дало змогу повністю встановити первинну структуру деяких ДНК, окремих фрагментів ДНК, а також структуру багатьох генів. Так, з'ясовано первинну структуру ДНК мітохондрій людини, яка побудована з 16 659 нуклеотидних пар (нп), вивчено первинну структуру ДНК вірусу SV-40, яка складається з 5224 нп. Досліджено первинну структуру генів: яєчного альбуміну (7564 нп), гормону росту людини (2600 нп), інсуліну людини (1430 нп), цитохрому щурів (960 нп) тощо. Значну роботу по вивченню первинної структури нуклеїнових кислот проводили дослідники на чолі з академіками О.О. Баєвим і Ю.О. Овчинниковим.
Вторинна структура. Просторова конфігурація полінуклеотидних ланцюгів ДНК становить її вторинну структуру. Модель структури молекули ДНК вперше була запропонована вченими із Кембріджського університету (Англія) Дж. Уотсоном і Ф. Кріком у 1953 р. Основою для побудови даної моделі стали відомості про хімічний склад ДНК, одержані Е. Чаргаффом, а також дані рентгеноструктурного аналізу, одержані Л. Уілкінсом, Р. Гослінгом і Р. Франкліном. Принципи побудови моделі відповідають властивостям носія спадкової інформації, тобто дають можливість пояснити, як здійснюється запис інформації, як вона відтворюється і змінюється при мутації.
Відповідно до моделі Дж. Уотсона і Ф. Кріка молекула ДНК це подвійна спіраль, тобто вона складається з двох полінуклеотидних ланцюгів, які закручені правильними витками навколо однієї спільної осі (рис. 3, а). Без розкручування вони не можуть відокремитися одна від одної. Полінуклеотидні ланцюги ДНК розміщені антипаралельно: 5'-кінець одного полінуклеотидного ланцюга знаходиться напроти 3'-кінця другого ланцюга. Вони обернені один до одного азотистими основами, а зовні розміщені залишки дезоксирибози і фосфорної кислоти.
Діаметр спіралі ДНК становить 2 нм, крок її 3,4 нм, кожний виток спіралі містить 10 пар нуклеотидів так, що кожна пара їх займає 0,34 нм по осі спіралі. Стабілізація подвійної спіралі здійснюється за рахунок водневих зв'язків і гідрофобної взаємодії.
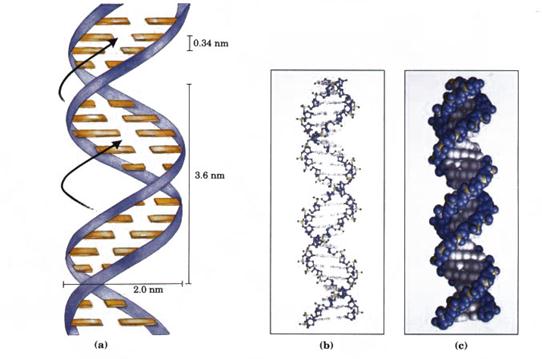
Рис. 3. Зображення подвійної спіралі ДНК (а) – за Дж. Уотсоном, Ф. Кріком;
(b) – молекулярна; (с) – атомна.
Утворення водневих зв'язків у молекулі ДНК – процес точно визначений. Так, аденін одного полінуклеотидного ланцюга завжди зв'язується двома водневими зв'язками з тиміном другого полінуклеотидного ланцюга, а гуанін постійно зв'язується трьома водневими зв'язками з цитозином. Ця закономірність називається комплементарністю (доповнюваністю). У подвійній спіралі ДНК аденін ніби доповнює тимін, а гуанін – цитозин і навпаки:

Отже, кожна пара нуклеотидів складається з однієї пуринової основи і однієї піримідинової, які доповнюють одна одну. З такого принципу будови ДНК випливає правило Чаргаффа, що вміст аденіну дорівнює вмісту тиміну, а вміст гуаніну дорівнює вмісту цитозину. Важливе значення в стабілізації спіралі ДНК мають неполярна взаємодія за участю делокалізованнх p-електронів азотистих основ. Квантово-механічні розрахунки електронної структури ДНК свідчать, що між комплементарними парами А – Т і Г – Ц відбувається перекривання p-орбіталей, а це приводить до того, що комплементарні пари азотистих основ утворюють одну p-електронну структуру. Разом з цим перекривання p-електронних систем азотистих основ відбувається і внаслідок їх паралельного розміщення у вигляді стопки всередині подвійної спіралі молекули ДНК. Найбільш значне перекривання p-орбіталей має місце тоді, коли пуринові основи знаходяться під піримідиновнми. При зворотному порядку розміщення основ перекривання p-орбіталей найменше. Така p-електронна взаємодія між паралельно розміщеними основами або парами основ у молекулі ДНК (так звана стекінг-взаємодія) становить єдину p-електронну систему, яка стабілізує подвійну спіраль ДНК більш істотно, ніж водневі зв'язки.
Двоспіральна ДНК залежно від умов (вмісту води, іонної сили та ін. може набувати певну конформацію). Так, на основі вивчення солей ДНК різних лужних металів з різною вологістю виявлено ряд форм двоспіральної ДНК:
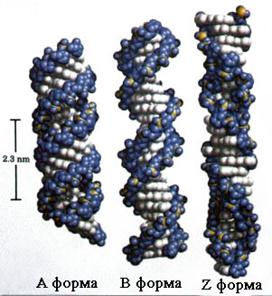
Значний інтерес становить вивчення таких форм ДНК, як А, В, С. При зміні вологості і катіона солі ці форми ДНК можуть переходити одна в одну. В-форма відповідно з моделлю Уотсона-Кріка є формою ДНК, яка найчастіше зустрічається в живих організмах і в розчинах (параметри структури вказані вище). В-форма перетворюється на А-форму, коли вологість препаратів ДНК становить менше 70%. А-форма відрізняється від В-форми тим, що пари азотистих основ розміщені не перпендикулярно до осі спіралі, а під кутом 70°. Внаслідок цього крок спіралі зменшується від 3,4 до 2,8 нм. В А-формі ДНК на один виток припадає одинадцять пар основ (у В-формі – 10), що зумовлює скорочення полінуклеотидного ланцюга приблизно на 25%. А-Конформація часто спостерігається в гібридних молекулах ДНК–РНК, оскільки додаткова гідроксильна група біля другого вуглецю залишку рибози заважає утворенню В-конформації ДНК.
С-форма характеризується більш пухкою і розкрученою структурою. На один виток припадає лише 9 нуклеотидів. Допускають, що в С-формі ДНК находиться у складі хроматину.
Аналіз даних різних форм ДНК свідчить про те, що В-форма найбільш адекватна для процесів реплікації, А-форма – для транскрипції, С-форма – для упаковки ДНК у складі надмолекулярних структур хроматину і деяких вірусів. Отже, вторинна структура молекули ДНК, очевидно, в першу чергу зв'язана з інформаційними процесами в живих системах, наприклад, А-форма з передачею інформації від ДНК до РНК. В-форма із збільшенням кількості інформації і С-форма – з її збереженням.
В останні десятиріччя з'явились дані про можливість існування принципово нових форм ДНК: Z- і SBS-форма – це лівозакручені форми ДНК. Діаметр молекули ДНК у Z-формі становить 1,8 нм, число нуклеотидів у витку дорівнює 12. Допускають, що у природній ДНК можуть чергуватись праві (А-, В-, С-форми) і ліві (Z-форма) ділянки.
SBS-Форми ДНК характеризуються відсутністю взаємного закручування полінуклеотидних ланцюгів навколо однієї спільної осі. Полінуклеотидні ланцюги в SBS-формі ДНК розміщуються поряд „бік в бік” (від англ. side by side, звідки назва – SBS-форма), утворюючи зигзагоподібну форму. Відсутність спіралізації ДНК у формі SBS забезпечує легке розходження полінуклеотитних ланцюгів, що має важливе значення для процесу реплікації ДНК.
Виділення ДНК з різних видів організмів та вивчення її структури показало, що дволанцюгові ДНК окремих прокаріотів – вірусів, бактерій і клітинних органел – мітохондрій та хлоропластів – не лінійні, а замкнуті в кільце. Наприклад, ДНК фага, який називають фагом лямбда, має лінійну форму доти, поки знаходиться у фаговій часточці, а коли попадає в бактеріальну клітину, замикається в кільце завдяки наявності в ланцюгах ДНК так званих „липких” кінців. На кожному кінці ДНК один із ланцюгів довший за інший і містить певну кількість неспарених основ. Такі ділянки неспарених основ на обох кінцях молекули комплементарні одна до одної. Тому при їх спарюванні кінці ланцюгів ніби „злипаються” і молекула набуває структури кільця, утворення якого завершує спеціальний фермент. Одноланцюгові кільцеві форми ДНК виявлені у фагах – фх 174, М 13 і S 13 Е. соlі.
Разом з цим треба зазначити, що в деяких мікроорганізмах виявлені одноланцюгові ДНК, які мають як лінійну, так і кільцеву структури. Так, в окремих вірусів (вірус поліомієліту, дрібний вірус мишей) знайдено лінійні одноланцюгові ДНК. Вони, на відміну від дволанцюгових ДНК, мають меншу молекулярну масу, в них часто не зберігається відповідне співвідношення між азотистими основами: А – Т і Г – Ц і т.д.
Третинна структура ДНК. Дослідження будови ДНК показало, що лінійні дволанцюгові або кільцеві форми ДНК можуть бути зорієнтовані у просторі з утворенням спіралізованих і суперспіралізованих форм, тобто третинної структури.
Про певне укладання (упаковку) ДНК у клітинах свідчить той факт, що молекула ДНК з молекулярною масою 106 повинна була б мати довжину 5 мкм, а насправді довжина її становить 0,5 мкм. Крім того, клітини прокаріот і органели клітин еукаріот, в яких локалізована основна маса ДНК, часто мають значно менші розміри, ніж розміри її молекули. Так, розмір подвійної спіралі ДНК бактерії Е. соlі більше 1 мм, а розмір самої клітини не перевищує 5 мкм.
Третинна структура ДНК (прокаріот і еукаріот) має свої особливості, пов'язані з будовою та функціями їх клітин. Для третинної структури ДНК вірусів і бактеріофагів характерним є наявність специфічної суперспіралізації одно- або дволанцюгових її кільцевих форм. Суперспіралізовані структури утворюють в основному ліву спіраль. Зустрічаються також суперспіралізовані кільцеві дволанцюгові ДНК, які закручуються самі на себе. Такі суперспіралі характерні для онкогенних вірусів і нехромосомних ДНК бактерій (плазмід) та мітохондрій.
Для третинної структури ДНК еукаріотичних клітин характерна також суперспіралізація, яка забезпечує економну упаковку ДНК в хроматині. Однак особливістю суперспіралізованої третинної структури ДНК еукаріот є те, що вона реалізується у формі складних комплексів ДНК з гістоновими і негістоновими білками, РНК та іонами металів.
Основну масу хроматину становлять білки – гістони, які за вмістом залишків аргініну і лізину поділяють на п'ять груп: Н1; Н2А; Н2В; НЗ; Н4. Взаємодія між гістонами і молекулами ДНК забезпечується за рахунок утворення іонних зв'язків між негативно зарядженими залишками фосфату та позитивно зарядженими групами діаміномонокарбонових кислот (аргініну і лізину). Негістонові білки містять велику кількість кислих амінокислот, тобто є поліаніонами. З даними білками пов'язують специфічну регуляцію активності хроматину.
Розрізняють кілька рівнів упаковки ДНК еукаріот у хроматині. Перший, найбільш вивчений, – нуклеосомний. До складу нуклеосом входять відрізки двоспіральної молекули ДНК довжиною 120 – 250 пар основ, Н1 і по дві молекули інших груп гістонів (октет гістонів). Гістоновий октамер утворює ядро нуклеосоми, або нуклеосомний кор, який являє собою диск діаметром 11 і товщиною 5,7 нм. На поверхню даного диска намотується відрізок двоспіральної молекули ДНК, утворюючи 1,75 витка. Між коровими ділянками нуклеосоми розміщуються перемички, або лінкери, які складаються з ділянок молекул ДНК довжиною 30 – 60 пар основ, зв'язаних з гістоном Н1 і негістоновими білками. Довжина лінкерів залежить від типу клітин. Близько 90 % усієї ДНК входить до складу нуклеосом – решта становить лінкерні ділянки. Вважають, що нуклеосоми – це фрагмент неактивного хроматину, а лінкерні міжкорові ділянки – фрагменти активного хроматину. Під електронним мікроскопом хроматин має вигляд намистин – кулеподібні нуклеосоми чергуються з ниткоподібними лінкерними міжкоровими ділянками (рис. 4). Упаковочний коефіцієнт даного рівня структури дорівнює п'яти, тобто внаслідок утворення нуклеосом довжина ланцюга ДНК зменшується в 5 разів.
Наступний рівень упаковки ДНК в хроматині – спіралізація і укладання нуклеосом у вигляді товстих фібрил – соленоїдів. Крок спіралі соленоїду дорівнює 11 нм, на 1 виток припадає 6 – 10 нуклеосом. У цілому завдяки наявності першого і другого рівнів упаковки ДНК у хроматині забезпечується зменшення довжини молекули в 40 – 50 разів.
Третій рівень упаковки ДНК у хроматині вивчено недостатньо. Вважають, що соленоїди утворюють суперспіралізовані петлі, що призводить до зменшення лінійних розмірів ДНК у 200 разів. Суперспіралізовані петлі – це домени ДНК, які відповідають, очевидно, одиницям транскрипції і реплікації хроматину. Петлеподібна, доменна організація сприяє укладанню хроматину в метафазних хромосомах у спіральні структури більш високого порядку. В результаті послідовного укладання молекул ДНК у хроматині лінійні розміри молекул ДНК зменшуються приблизно в 104 разів.
Рибонуклеїнові кислоти (рнк)
Рибонуклеїнові кислоти, (РНК) як і дезоксирибонуклеїнові кислоти (ДНК), є досить важливими компонентами клітин усіх живих організмів. Молекули РНК, що містяться в клітині, відрізняються будовою, функціями, розмірами, складом та локалізацією. Основна маса РНК міститься в цитоплазмі (90 %), решта – в ядрі та інших органелах клітин.
У цитоплазмі клітин міститься РНК кількох видів: рибосомальна (рРНК), транспортна (тРНК), інформаційна (іРНК) або матрична (мРНК). Частина РНК знаходиться в ядрі – ядерна РНК (яРНК). Вміст ядерної РНК становить 4 – 10% загального вмісту РНК клітини. В ядрі, як правило, синтезуються високомолекулярні попередники – преРНК, інформаційної, транспортної і рибосомальної РНК. Особливу фракцію складає так звана гетерогенна ядерна РНК (гяРНК), вміст якої 2 – 10%. Вона відзначається досить високою молекулярною масою і ДНК-подібним нуклеотидним складом; гяРНК є основним попередником цитоплазматичної РНК.

Рис. 4. Рівні упаковки ДНК
Крім цих видів РНК з інфікованих вірусами клітин виділено вірусні РНК. Ці РНК зберігають і передають наступним поколінням закодовану в них генетичну інформацію. Геномні РНК мають найбільшу молекулярну масу, яка досягає кількох мільйонів. До складу молекул входять десятки тисяч нуклеотидів.
Для РНК, як і для ДНК, характерні кілька рівнів структур.
Первинна структура. Основою хімічної будови РНК є полінуклеотиди різної довжини. Послідовність чергування залишків відповідних мононуклеотидів в ланцюгах становить первинну структуру РНК.
Дослідження первинної структури різних видів РНК свідчить про те, що для них характерна переважно така сама закономірність у співвідношеннях нуклеотидів, як і для ДНК. Слід зазначити, що до складу РНК з азотистих основ замість тиміну входить урацил, проте в РНК сума пуринових основ не завжди відповідає сумі піримідинових. Їх співвідношення в РНК змінюється в широких межах. Для РНК, порівняно з ДНК, менш виражена і видова специфічність.
Нині вивчено первинну структуру більш як п'ятидесяти тРНК. Назва цих тРНК походить від амінокислот, які вони переносять до місця біосинтезу білка. Успішно ведуться дослідження з вивчення первинної структури інших видів РНК. Так, вивчена первинна структура різних видів низькомолекулярних рибосомальних РНК. Повністю з'ясовано первинну структуру РНК бактеріофага MS2 (бактеріофаг MS2 є мікровірусом, що паразитує на кишечній паличці), яка складається із 3569 нуклеотидних залишків. Проводяться роботи з вивчення нуклеотидної послідовності високомолекулярних рибосомальних і вірусних РНК. Зараз уже встановлена первинна структура значних фрагментів РНК фагів R17 і 16S-рРНК.
Вторинна структура. РНК, на відміну від ДНК, побудована з одного полінуклеотидного ланцюга, для якого властива своєрідна спіралізація. Полінуклеотидний ланцюг РНК закручується сам на себе, утворюючи водневі зв'язки між азотистими основами аденін – урацил і гуанін – цитозин.
Особливістю вторинної структури РНК є те, що полінуклеотидний ланцюг спіралізований не повністю. Крім того, на відміну від ДНК, спіралізація окремих ділянок полінуклеотидного ланцюга РНК менш досконала. У РНК немає повної відповідності в чергуванні комплементарних основ, що призводить до утворення виступів в окремих нуклеотидів на поверхні спіралі полінуклеотидного ланцюга.
Кількість і величина спіралізованих ділянок у межах одного ланцюга для різних РНК неоднакові. Низький ступінь спіралізації властивий для мРНК, що, очевидно, пов'язано з їх функцією в процесі біосинтезу білка. Наявність значної кількості спіралізованих ділянок ускладнювало б виконання ними функцій матриці під час синтезу поліпептидного ланцюга на рибосомах. Разом з цим на початку полінуклеотидних ланцюгів окремих мРНК виявлені значні спіралізовані ділянки. Можливо, що складна просторова конформація 5'-кінця мРНК необхідна для розпізнавання її факторами ініціації на етапі трансляції генетичної інформації.
Вищий ступінь спіралізації (понад 50%) властивий для транспортних і рибосомальних РНК.
Крім указаних загальних закономірностей кожен вид РНК характеризується особливостями структури, певними властивостями та функціями.
Інформаційні, або матричні, РНК. Це досить важливий вид РНК клітини. Вміст її становить 2 – 6% загальної кількості РНК. Уперше наявність у клітині іРНК передбачили А.М. Білозерський та О.С. Спірін у 1956 p. на основі досліджень AT і ГЦ типу нуклеїнових кислот. Дослідженнями було встановлено позитивну кореляцію між нуклеотидним складом ДНК і певного виду РНК. На основі цих даних зроблено висновок про те, що в передачі спадкової інформації від ДНК до білка бере участь один з видів РНК, який корелює з нею за нуклеотидним складом. Експериментально іРНК було виявлено в 1961 p. С. Спігелменом і Ф. Кріком. Враховуючи те, що дана РНК бере участь у забезпеченні матричного синтезу білка і передачі генетичної інформації, вона дістала назву матричної або інформаційної (мРНК, або іРНК). Синтезується іРНК на ДНК (процес транскрипції). У прокаріот синтезована іРНК може зразу без будь-яких змін використовуватися у вигляді матриці, а в еукаріот в процесі транскрипції утворюється високомолекулярна проРНК, яка піддається процесінгу, внаслідок чого утворюється зріла молекула іРНК. У клітині іРНК представлена молекулами, що відрізняються за величинами молекулярної маси та нуклеотидним складом, тобто первинною структурою, оскільки кожний білок, що синтезується під час трансляції, використовує для відтворення первинної структури свою матрицю. Генетична інформація закодована на структурі іРНК у цистронах або структурних генах. іРНК, що кодує один білок, називається моноцистронною, якщо кілька білків – поліцистронною. В цьому випадку між цистронами знаходяться спейсери – ділянки, що не кодують синтез білків. Для прокаріот характерна поліцистронна, а для еукаріот моноцистронна іРНК.
Основою хімічної будови іРНК є полінуклеотиди різної довжини. Послідовність чергування нуклеотидів у ланцюгах є первинною структурою іРНК.
Загальна будова іРНК прокаріот і еукаріот однакова, хоча існують певні особливості.
У клітинах еукаріот іРНК знаходиться в комплексі з білками, які стабілізують її структуру. Матричні рибонуклеопротеїдні комплекси, що утворюються при цьому, називаються інформосомами. Особливістю іРНК еукаріот є наявність в її складі структур, які не кодуються відповідними генами ДНК, а добудовуються в процесі посттранскрипційної модифікації первинних транскриптів, які піддаються процесингу.
Так, на 5'-кінці іРНК еукаріот знаходиться ділянка, що дістала назву кеп (від англ. сap – шапочка), в складі якої міститься мінорний нуклеозидтрифосфат-7-метилгуанозин. За кепом знаходиться ділянка з метильованими нуклеозидмонофосфатами. Для різних видів іРНК кількісний вміст та якісний склад їх різні. Вважають, що наявність кепу на 5'-кінці іРНК захищає її від дії ферментів нуклеаз.
Далі розміщується 5'-нетранслююча послідовність (5'-НТП) нуклеотидів, багата АГ-парами. Вважають, що ця ділянка забезпечує сполучення іРНК з рибосомою. Ділянка рРНК, з якою контактує іРНК, багата УЦ-парами, тобто ділянки комплементарні одна одній. На 3'-кінці іРНК прокаріот також міститься нетранслююча послідовність, однак довжина їх значно менша, ніж в іРНК еукаріот, і становить 10 – 30 нуклеотидів. 5'-Кінцевий нуклеотид, як правило, містить азотисту основу пуринового ряду аденозин- чи гуанозинтрифосфат (5' ФФФГ...3'). У складі 5'-НТП усіх іРНК прокаріот виявлена особлива послідовність з 3 – 9 нуклеотидів (послідовність Шайна-Дальгарно), яка комплементарна 3'-кінцю 16S рРНК і полегшує ініціацію трансляції іРНК.
Після нетранслюючої зони на структурі іРНК міститься ініціюючий кодон АУГ, а в деяких іРНК ГУГ. Вони пізнаються як ініціюючі лише тоді, коли знаходяться на місці, з якого починається синтез поліпептиду. Якщо кодони розміщені всередині структурних генів, то вони читаються як метіонін (АУГ) і валін (ГУГ). Далі розміщуються цистрони або структурні гени, в яких у вигляді триплетів закодовані певні амінокислоти. Завершується цистрон термінаторними кодоном УАА, УАГ або УГА. У випадку поліцистронної іРНК термінаторні кодони розміщуються в кінці кожного цистрону.
Після цистронів на 3'-кінці іРНК еукаріот міститься нетранслююча послідовність (3'-НТП), до складу якої входить від 100 до 1000 мононуклеотидів. 3'-НТП прокаріот значно коротша, функції її вивчені недостатньо.
Закінчується 3'-кінець іРНК еукаріот поліаденіловою послідовністю, яка містить 150 –200 залишків поліаденілової кислоти. Вона приєднується до 3'-кінця іРНК в ядрі після закінчення транскрипції за участю ферменту поліаденілатполімерази.
Вважають, що біологічна функція поліаденілової послідовності – стабілізація молекули іРНК та продовження часу її функціонування. За один цикл проходження іРНК крізь рибосому відщеплюється один залишок аденозинмонофосфату від поліаденілової послідовності. Втрата поліаденілової послідовності призводить до руйнування іРНК.
Вторинна структура іРНК представлена у вигляді кількох двоспіральних шпильок, які утворюються в межах одного полінуклеотидного ланцюга внаслідок комплементарного спарювання А–У і Г–Ц пар. Шпильки зв'язані між собою короткими одноланцюговими ділянками. Вважають, що шпильки на структурі іРНК відіграють певну роль у забезпеченні процесів ініціації і термінації. При зв'язуванні з рибосомою вся просторова структура іРНК не порушується, а відбувається лише деспіралізація ділянок у місцях безпосереднього контакту іРНК з рибосомою.
Третинна структура іРНК вивчена недостатньо. Припускають, що молекули іРНК можуть змінювати третинну структуру залежно від умов зовнішнього середовища, температури, іонної сили, розчину, рН тощо.
Транспортні РНК (тРНК). Це один з видів рибонуклеїнових кислот клітини, який відіграє важливу роль у забезпеченні перенесення активних форм амінокислот – аміноациладенілатів до рибосомального апарату, де вони використовуються при білковому синтезі. тРНК становлять 10 – 15% всієї РНК клітини. Вони локалізовані переважно в гіалоплазмі клітини, ядерному соку і в безструктурній частині мітохондрій хлоропластів.
Характерною ознакою тРНК є невелика молекулярна маса – 20 – 35 тис. При вивченні первинної структури тРНК встановлено, що вони побудовані переважно з 70 – 90 нуклеотидних залишків і мають певні спільні ознаки. Так, на 5'-кінці полінуклеотидного ланцюга здебільшого знаходиться залишок гуанозинмонофосфорної (ГМФ), а на 3'-кінці – фрагмент, який складається з двох залишків цитидинмонофосфорної кислоти і одного залишку аденозинмонофосфорної кислоти (ЦМФ, ЦМФ, АМФ). Між ними в полінуклеотидному ланцюгу в точно визначеній послідовності розміщені всі інші пуринові і піримідинові нуклеотидні залишки. Серед них близько 8 – 10% нуклеотидів, які містять мінорні основи: псевдоуридин, різні метильовані похідні аденіну, гуаніну, цитозину тощо.
Найпоширенішими мінорними основами в нуклеотидах тРНК є псевдо- і дигідроуридин. Вважають, що мінорні основи підвищують стійкість тРНК проти гідролізу під час дії на них рибонуклеаз. Крім того, деякі мінорні основи беруть участь у кодуванні амінокислот, розпізнаванні ферментом аміноацил-тРНК-синтетазою тієї тРНК, яка взаємодіє з певною амінокислотою під час її активування.
Уперше первинну структуру тРНК розшифрував Р. Холлі із співробітниками у 1965 p. Це була тРНК, яка здійснює перенесення амінокислоти аланіну, тобто аланінова тРНК (тРНКала). Значний внесок у вивченні первинної структури тРНК зробили академік О.О. Баєв і його співробітники. Вони повністю розшифрували первинну структуру тирозинової РНК (тРНКтир).
Для тРНК характерними є і вищі рівні структури (вторинна, третинна), що забезпечуються спіралізацією в межах одного полінуклеотидного ланцюга, що при цьому закручується „на себе”, утворюючи складну просторову структуру тРНК.
Вторинна структура тРНК однотипна для всіх їх видів і представлена у вигляді листка конюшини (рис. 5), що містить п'ять спіралізованих ділянок, чотири з яких закінчуються петлеподібними структурами.
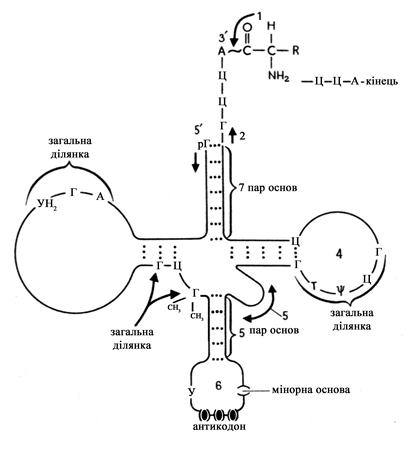
Рис. 5. Вторинна структура тРНК
Вони не містять спарених нуклеотидів, а п'ята закінчується додатковою петлею, функції якої не з'ясовані. В центрі молекули знаходиться неспіралізована ділянка; 3'- та 5'-кінці молекули, сполучені за рахунок комплементарних пар основ і утворюють акцепторне стебло.
Акцепторне стебло – найдовша спіралізована структура в молекулі тРНК, що містить сім спарених основ. Завершується ця ділянка неспареною послідовністю нуклеотидів ЦЦА, розміщеною на 3'-кінці молекули. До 3'-ОН групи кінцевого залишку аденіну приєднується відповідна амінокислота, яка переноситься від аміноациладенілатів на етапі рекогніції.
Утворені при цьому аміноацил-тРНК використовуються у вигляді адапторів, забезпечуючи переведення послідовності нуклеотидів іРНК на амінокислотну послідовність білкової молекули, тобто забезпечують один з етапів трансляції. На протилежному кінці молекули тРНК міститься антикодонова ділянка, що містить п'ять спарених і сім неспарених нуклеотидів, які утворюють антикодонову петлю. У центральній ділянці антикодонової петлі міститься антикодон – триплет, комплементарний кодону іРНК, що кодує відповідну амінокислоту. Так, кодону на іРНК 5'-ГЦЦ-3' відповідає антикодон 3'-ЦГГ-5'. У процесі трансляції кодон іРНК сполучається з антикодоном тРНК водневими зв'язками (кодон-антикодонова взаємодія). Антикодон тРНК є точною копією кодогену ланцюга ДНК, в якому тимін замінено на урацил.
Серед інших петлеподібних структур тРНК найважливіше значення мають:
а) псевдоуридилова петля. Складається вона з семи мононуклеотидних ланок, серед яких завжди зустрічається послідовність 5'-ТyЦГ-3¢, що містить псевдоуридин, який зв'язується водневим зв'язком з мінорною основою РНК – тиміном. Вважають, що дана петля забезпечує взаємодію тРНК з рибосомою (50S-субодиницею);
б) дигідроуридилова петля (D-петля) містить кілька мононуклеотидів, в складі яких знаходиться мінорна азотиста основа дигідроуридин. Дигідроуридилова петля забезпечує взаємодію тРНК з специфічним ферментом (аміноацилсинтетазою);
в) додаткова петля, функції якої мало вивчені.
Третинна структура тРНК досить компактна (рис. 6). Утворюється вона внаслідок наближення окремих ділянок вторинної структури. L-Подібна структура, що утворюється при цьому, дістала назву ліктьового згину (рис. 7). В утвореній структурі антикодонова петля розміщується на одному кінці молекули, а акцепторна – на іншому. При цьому за рахунок акцепторної ділянки утворюється одна подвійна спіраль, а за рахунок спареної ділянки антикодонової петлі – друга. Спіралізовані ділянки розміщуються одна відносно одної під кутом 92°. D-Петля і ТyЦГ-петля взаємодіють одна з одною, утворюючи кут ліктьового згину.

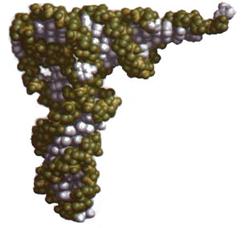
Рис. 6. Третинна структура тРНК Рис. 7. „Ліктьовий згин”
Структура тРНК стабілізується водневими зв'язками та стекінг-взаємодією. Певну роль у стабілізації вищих рівнів структури відіграють іони Мn2+ і Mg2+. Вважають, що третинна структура спільна для всіх тРНК. Незначні відмінності в будові різних тРНК забезпечує специфічне пізнавання їх ферментом аміноацил-тРНК-синтетазою і сполучення з відповідними амінокислотами.
Рибосомальні РНК (рРНК). Рибосомальні РНК є досить важливою групою рибонуклеїнових кислот клітин про- і еукаріот. Вони є структурною основою рибосом – клітинних органел, на яких відбувається досить важливий етап синтезу білка – трансляція. Крім цитоплазматичних рибосом, рРНК забезпечує структуру та функціональну активність рибосом таких важливих органел клітин, як мітохондрії та хлоропласти, що містять автономний апарат синтезу білка.
У складі рибосом рРНК знаходиться в комплексі з білками (рибонуклеопротеїдні комплекси). Молекули рРНК мають, як правило, Y-подібну форму й утворюють каркас, до якого прикріпляються білки, внаслідок чого утворюється щільна компактна структура, яка формує великі та малі субодиниці рибосом. Залежно від набору білків та рРНК великі і малі субодиниці рибосом мають різні константи седиментації: 30S, 50S, 40S, 60S та ін. 30S- і 505-субодиниці формують 70S-рибосому прокаріот, а 40S і 60S відповідно 80S-рибосому еукаріот. Молекулярна маса рРНК різна, в зв'язку з чим розрізняють низько- та високомолекулярні рРНК. Так, з субодиниць рибосоми бактерії Е. соlі виділено рРНК з константами седиментації 23S і 16S з молекулярною масою 1,1 • 106 та 0,56 • 106, що містять відповідно 3200 та 1600 нуклеотидних пар. Крім того, в складі субодиниць виявлено також низькомолекулярну рРНК (5S РНК) з молекулярною масою 4 • 104, кількість нуклеотидних пар в якій становить 120.
Подібний набір рРНК характерний і для субодиниць рибосом, виділених з клітин печінки: 23S, 18S, 5S та 5,8S-PHK, з молекулярною масою відповідно 1,6 • 106; 0,65 • 106; 4 • 104; 5 • 104. Характерним є те, що 28S-рРНК за величиною молекулярної маси варіює в різних видів тварин залежно від рівня еволюції: від 1,5 млн в морських безхребетних до 2 млн у ссавців. Для нуклеотидного складу рРНК характерними є наявність великої кількості пуринових блоків, що містять гуанілові мононуклеотиди та майже повна відсутність модифікованих азотистих основ мононуклеотидів.
Кожний вид рРНК має характерну, властиву для нього первинну структуру, яка відрізняється кількісним вмістом, якісним складом та порядком розміщення мононуклеотидних ланок у полінуклеотидному ланцюгу.
Вторинна структура рРНК утворюється за рахунок спіралізації молекули в межах одного полінуклеотидного ланцюга, внаслідок чого відбувається формування коротких двоспіральних структур – шпильок. У вигляді шпильок організовано близько 2/3 поверхні молекули рРНК, решта представлена одноланцюговими „аморфними” ділянками, з якими зв'язуються білки рибосом.
Подібну будову мають також рРНК мітохондрій тваринних клітин та хлоропластів рослинних клітин, однак вони мають специфічний нуклеотидний склад та відрізняються деталями просторової структури. Для їх молекул характерним є нижчий ступінь спіралізації. Особливістю рРНК мітохондрій і хлоропластів є також незначний вміст в їхньому складі низькомолекулярних РНК. Так, у мітохондріях відсутні 5S- і 5,8S-РНК, а в хлоропластах відсутня 5,8S-PHK.
Вірусні РНК. Вірусні РНК є складовою частиною РНК-вмісних вірусів і фагів. На відміну від більшості клітин про- та еукаріот геном вірусів, як правило, організований за участю одного виду нуклеїнових кислот. У зв'язку з цим розрізняють. ДНК- та РНК-вмісні віруси. На відміну від канонічних форм біополімерів клітини (дволанцюгова ДНК і одноланцюгова РНК), будова, властивості та просторова орієнтація компонентів вірусного геному можуть бути найрізноманітнішими. Молекули вірусних РНК відрізняються між собою молекулярною масою – від сотень тисяч до десятків мільйонів, якісним складом, кількісним вмістом та чергуванням мононуклеотидних ланок у полінуклеотидному ланцюгу (первинною структурою), способом укладання молекули в просторі та здатністю до передачі генетичної інформації. Високомолекулярні вірусні РНК зі значеннями молекулярної маси наближаються до значень молекулярної маси, характерних для ДНК.
Первинна структура вірусних РНК досить різноманітна і значною мірою визначає як просторове укладання полінуклеотилного ланцюга, так і до певної міри характер патогенної дії.
Просторову структуру вірусних РНК можна представити одноланцюговими лінійними формами, які закручуються самі на себе (віруси поліомієліту і корі), одноланцюговими кільцевими формами (бунья-віруси), дволанцюговими молекулами (рота-віруси гастроентеритів) тощо. Майже 80% вірусів людини і тварин належать до так званих РНК-геномних вірусів, у яких генетична інформація закодована в чергуванні мононуклеотидних ланок на структурі РНК, тобто вірусна РНК виконує роль носія генетичної інформації. Однак не всі молекули вірусних РНК забезпечують передачу закодованої в них генетичної інформації і в процесі трансляції можуть виконувати роль матриці при синтезі білка. Це стосується вірусів з негативним геномом, у яких роль матриці виконує не сама вірусна РНК, а її реплікативна копія (реплікативна форма), що утворюється при дії ферменту транскриптази. Реплікативні форми вірусної РНК існують у вигляді дволанцюгових РНК (РНК-фрагментів). Прикладом може бути велика кількість вірусів, що викликають інфекційні захворювання людини і тварин.
Особливу групу реплікативних форм складають вірусні РНК, що входять до складу геному неопластичних вірусів, які спричиняють розвиток таких захворювань, як лейкемія, рак, саркома. Це так звані ретро-віруси, які передають генетичну інформацію за рахунок утворення РНК ДНК реплікативних форм, ланцюг ДНК яких реплікується з утворенням дволанцюгової ДНК, що несе інформацію, одержану від вірусних РНК, і далі інтегрується в геном інфікованих клітин, що разом з іншими факторами може викликати розвиток неопластичних процесів.
Для вірусних РНК характерними є вищі рівні структури, які забезпечують компактне укладання їхніх молекул. Про існування вищих рівнів структури вірусних РНК свідчить той факт, що якби молекули високомолекулярних вірусних РНК існували в лінійній формі, то довжина б їх була значно більшою, ніж довжина клітин, в яких вони виявляють патогенну дію. Встановлено, що залежно від умов середовища (значення рН, іонної сили, температури) вірусні РНК можуть знаходитись у вигляді компактної палички, пухкого клубка чи розгорнутої нитки.
– Конец работы –
Эта тема принадлежит разделу:
З історії розвитку біохімії
Лекція Методи дослідження в біохімії Живі системи та їх організація НАПРЯМИ І МЕТОДИ ДОСЛІДЖЕННЯ В... Лекція Біогенні вуглеводи Загальна... Лекція Біогенні ліпіди Загальна характеристика будова та функції...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Будова нуклеїнових кислот
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов