рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Тема 1. Введення в фізико-хімічні методи аналізу.
Реферат Курсовая Конспект
Тема 1. Введення в фізико-хімічні методи аналізу.
Тема 1. Введення в фізико-хімічні методи аналізу. - раздел Философия, Тема 1. Введення в фізико-хімічні методи аналізу Що Являє Собою ДисциплінаАналітична Хімія?В ...
Що являє собою дисциплінааналітична хімія?В 1992 році Федерація європейських хімічних товариств оголосила конкурс на краще визначення аналітичної хімії. Було вибране наступне визначення, дане Карлом Камманом, німецьким хіміком:
Аналітична хімія надає методи і засоби, необхідні для того, щоб заглянути в матеріальний світ… з метою відповіді на основні питання, які стосуються зразка матеріалу:
· Що?
· Де?
· Скільки?
· Яке розміщення, структура, форма.
Дисципліна аналітична хімія складається з якісного і кількісного аналізу. Завдання першого – ідентифікація елементів, йонів або сполук, присутніх у зразку, завдання кількісного – визначення того, скільки даного компонента (одного чи кількох) міститься у зразку.
1. В результаті стрімкого науково-технічного прогресу і розвитку нових галузей науки, техніки і народного господарства існуючі хімічні методи не в змозі були задовільнити зростаючі запити аналітичної практики, зокрема, знизити межу виявлення до 10-5-10-10%. Хімічними методами аналітичної хімії (класичними – гравіметрією чи титриметрією) визначити настільки малі кількості неможливо. Хімічні методи аналізу дозволяють визначати якісний компонентний склад речовин з межею виявлення 10-3-10-5 %. Діапазон кількісного визначення концентрацій компонентів складає 0,01-100 % при відносній точності результатів аналізу 0,2 %. Хімічні методи аналізу характеризуються використанням простого обладнання, але вимагають застосування великої кількості ручних операцій і тривають довгий час (від десятків хвилин до декількох годин), слабко піддаються автоматизації. Кількісний аналіз речовин, вміст яких не перевищує 0,01 %, практично неможливий. Тільки застосування фізико-хімічних методів аналізу (ФХМА) дозволяє вирішити аналітичні завдання такого роду.
Широке поширення фізико-хімічних методів аналізу, в першу чергу, пов’язано з тим, що ці методи володіють значно більшою чутливістю у порівнянні з хімічними методами. Висока чутливість фізико-хімічних методів аналізу робить їх незамінними у виробництві речовин високої і надвисокої чистоти, абсолютно необхідних сучасній науці і техніці, вони можуть забезпечити достатньо надійне визначення домішок у кількості 10-8-10-10 %. Якщо звичайними хімічними методами можна визначити концентрацію речовини 10-5 моль/л, то для деяких фізико-хімічних методів визначуваний мінімум менший приблизно на 5 порядків, тобто 10-9 - 10-10моль/л.
При аналізі об'єктів навколишнього середовища і екологічному контролі діючих виробництв необхідно проведення аналізу великої кількості проб повітря, стічних вод, відходів виробництва. Це вимагає розробки експресних автоматизованих методів аналізу. Тут також допомагають ФХМА, другою важливою перевагою яких є їх експресність, а також швидкість, з якою проводиться визначення: в багатьох випадках – це секунди, за які можна оцінити положення стрілки на шкалі пристрою. Багато приладів дозволяють автоматизувати сам процес аналізу або деякі його стадії: автоматичні газоаналізатори контролюють склад повітря в шахтах; автоматизований газохроматографічний аналіз в нафтохімічній, коксохімічній і інших галузях промисловості.
Фізико-хімічні методи дозволяють провести аналіз на відстані: яскравий приклад – аналіз місячного грунту рентгенофлуоресцентним приладом безпосередньо на Місяці.
Інколи виникає необхідність аналізувати об'єкт без руйнування (без відбирання проби) Фізико-хімічний аналіз може бути виконаний без руйнування досліджуваного зразка (недеструктивний аналіз), що має велике значення для криміналістики, медицини.
Не завжди потрібно визначати середній склад об’єкта, а потрібний склад в деяких точках на поверхні чи в об'ємі об'єкта (локальний аналіз). Цей аналіз має значення в матеріалознавстві і інших областях, де склад окремих включень визначає якість матеріалу, а також в мінералогії, археології, криміналістиці. Цим вимогам також найбільш повно відповідають фізико-хімічні методи аналізу (ФХМА).
2. Хімічні і фізичні властивості речовин настільки ж різноманітні, як і аналітичні методи, які на них грунтуються. Всі аналітичні методи грунтуються на отриманні і вимірюванні аналітичного сигналу – будь-якого прояву хімічних або фізичних властивостей речовини, який можна використовувати для встановлення якісного складу досліджуваного об’єкту чи для кількісної оцінки його компонентів.
За походженням аналітичного сигналу всі методи можна розділити на хімічні, фізико-хімічні і фізичні, хоча чіткої межі між хімічними і фізико-хімічними, фізико-хімічними і фізичними методами немає.
Характерною особливістю фізико-хімічних методів у порівнянні з хімічними є те, що в них використовується не просто взаємодія речовини з тим чи іншим реактивом, а й взаємодія речовини з різними видами енергії (наприклад, електричною, тепловою, енергією електромагнітного випромінювання). Відмінність ФХМА від хімічних методів полягає і в тому, що для одержання видимого аналітичного сигналу використовують прилади, які перетворюють яку-небудь властивість хімічної системи в переважно електричний сигнал, який легко зареєструвати вимірювальними приладами або записати у вигляді графіків на паперових носіях чи дисплеях.
Фізико-хімічні методи аналізу поділяються на 2 групи:
1. Власне фізико-хімічні методи, які грунтуються на вимірюванні фізичних або фізико-хімічних властивостей (параметрів) системи при проведенні хімічної реакції з об'єктом аналізу.
2. Фізичні методи аналізу, які грунтуються на вимірюванні фізичних властивостей (параметрів) системи без проведення хімічних реакцій.
Отже, головна відміна полягає в тому, що фізико-хімічні методи грунтуються на хімічних реакціях. Часто для отримання сигналу визначуваний компонент переводять з однієї хімічної форми у іншу, найбільш зручну для даного методу; для досягнення необхідної точності, чутливості, і для швидкого виконання аналізу фізико-хімічним методом велике значення має вибір реактиву і умов проведення реакції. У фізичних методах агрегатний стан і хімічна форма речовини в більшості випадків немає значення, хімічні реакції відсутні або мають другорядне значення. Однак виділення фізичних методів принципового значення немає.
Об'єднує ці методи те, що аналітичний сигнал вимірюється за допомогою приладів (інструментів), тому інколи ці методи називаються інструментальними.
Інструментальні методи мають свої особливості. Одна з них – необхідність калібрування шкали пристрою з допомогою еталонів – зразків, склад яких точно відомий. Хімічні методи є безеталонними і дозволяють безпосередньо знайти вміст визначуваної речовини: в гравіметрії – за масою осаду, в склад кого входить визначуваний компонент, в титриметрії – за об’ємом витраченого титранту.
Класичні хімічні методи поступово відходять перед інструментальними, однак повністю свого значення не втрачають. Адже вони залишаються неперевершеними за точністю: відносні похибка визначення не перевищує 0,1-0,2%, тоді як похибка багатьох інструментальних методів (що є їх недоліком) – 2,5%. Вони незамінні там, де при високому вмісті потрібна висока точність і немає серйозних обмежень за часом (аналіз готової продукції, виготовлення еталонів). Тому контроль за достовірністю результатів, визначення кількісного складу стандартних зразків для аналізу залишається за хімічними методами.
Суттєвим недоліком більшості фізико-хімічних методів є також те, що для їх практичного застосування необхідні еталони, стандартні розчини і калібрувальні графіки.
Класифікація ФХМА основана на спільності теоретичних і практичних принципів одержання аналітичного сигналу. Загальне число ФХМА перевищує декілька десятків, але найбільш поширені такі:
1) хроматографічні методи аналізу;
2) спектральні і інші оптичні методи;
3) електрохімічні методи;
4) радіометричні методи;
5) масспектрометричні методи.
Серед вказаних груп найбільш чисельною і найважливішою за практичним значенням є група спектральних(спектроскопічних) і інших оптичних методів аналізу. Вона включає методи атомно-емісійної спектроскопії, атомно-абсорбційної спектроскопії, інфрачервоної спектроскопії, молекулярно-абсорбційної спектроскопії, люмінесценції, нефелометрії і турбідиметрії та інших методів, які ґрунтуються на вимірюванні різних ефектів при взаємодії речовини з електромагнітним випромінюванням.
Хроматографічні методи ґрунтуються на вибірковому поглинанні (адсорбції) окремих компонентів аналізованої суміші різними адсорбентами. Відомо, що в даний час за допомогою хроматографії виконується близько 60% всіх аналізів. Сюди входять методи газової і газорідинної хроматографії, рідинної розподільної, тонкошарової, йонообмінної і інших видів хроматографії.
Поряд з класичними, спектроскопічними та хроматографічними методами, одним з “стовпів” аналітичної хімії є електрохімічні методи. Група електрохімічних методів грунтується на вимірюванні електричних властивостей досліджуваної системи (електричної провідності, потенціалу, сили струму) і включає методи кондуктометрії, потенціометрії, вольтамперометрії, кулонометрії, електрогравіметрії.
Радіометричні методи аналізу основані на вимірюванні випромінювання радіоактивних елементів.
Мас-спектрометричні методи аналізу грунтуються на визначенні окремих іонізованих атомів, молекул і радикалів шляхом розділення потоків йонів в результаті комбінованої дії електричного і магнітного полів.
Крім методів, в яких використовуються прилади, що грунтуються на одному принципі, існують методи, в яких використовуються різні принципи для одержання аналітичного сигналу. Такі методи називаються гібридними.
Майже у всіх фізико-хімічних методах для встановлення складу речовини використовують два основні методичні прийоми: метод прямих вимірювань і метод титрування (непрямих вимірів).
3. В прямих вимірах використовується залежність аналітичного сигналу від природи аналізованої речовини і його концентрації. У загальному вигляді, процес одержання даних про хімічний склад об'єкта аналізу в прямих методах складається з таких етапів (рис. 1.1):
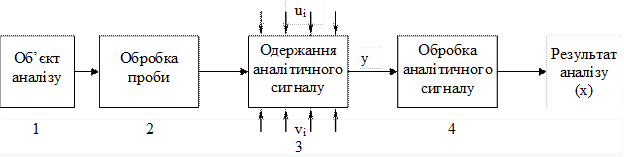
Рис. 1.1. Загальна схема проведення аналізу
1. Відбір проби. Об'єкти аналізу можуть бути тверді, сипучі, рідкі, газоподібні речовини або суміші, які знаходяться в різних місткостях, в яких вони зберігаються або транспортуються, а також у трубопроводах. Маса таких об'єктів може складати кілограми і навіть тони. Для того, щоб одержати інформацію про склад об'єкта аналізу, необхідно відібрати порівняно невелику пробу (10-100г) і доставити її в аналітичну лабораторію, яка є на будь-якому хімічному виробництві. Проба повинна бути представницькою, тобто склад і властивості її повинні відповідати середньому складу і властивостям об'єкта аналізу. Існують певні правила відбору представницьких проб у залежності від характеру і агрегатного стану об'єкта, які обумовлюються державними стандартами. Цих правил необхідно дотримуватися.
2. Обробка проби. Перед аналізом проба піддається обробці. Це можуть бути фізичні, хімічні, механічні та інші процеси: подрібнення, розчинення, виділення з проби визначуваних компонентів, переведення в іншу хімічну сполуку, відокремлення компонентів, які заважають визначенню, тощо.
3. Одержання аналітичного сигнала. Аналітичний сигнал – це кількісна характеристика, величина якої пов'язана з хімічним складом аналізованої речовини.
У хімічному аналізі підготована проба піддається дії певних реактивів і нескладних хімічних операцій (відокремлення осадів, висушування, зважування, визначення об'єму тощо). Аналітичний сигнал одержують у вигляді видимого результату перебігу хімічної реакції: утворення осаду, забарвлення розчину, маси речовини точно відомого складу, об'єму титранта.
Аналітичний сигнал фізико-хімічних методів аналізу одержують за допомогою приладів. Це можуть бути: сила струму, потенціал, інтенсивність випромінювання або поглинання світла (однопараметровий сигнал), а також їх залежність від часу, об'єму розчину, довжини хвилі (двопараметровий сигнал). Можуть бути навіть трипараметрові сигнали. Чим більша розмірність сигналу, тим більша його інформативність, але тим складніший прилад.
Відповідно, слід розрізняти методи, засновані на вимірі інтенсивності сигналу в єдиній вимірювальної позиції (наприклад, вимірювання світлопоглинання при одній довжині хвилі) одновимірні, і методи, в яких використовують декілька вимірювальних позицій (реєстрація повного спектру поглинання в оптичних методах аналізу) - двовимірні. Методи першої групи придатні лише для однокомпонентного аналізу. Двовимірні методи, можна використовувати і для багатокомпонентного аналізу.
Як правило, класичні методи такі, як гравіметрія і титриметрія, є одновимірними.
До двовимірним методів відносяться багато інструментальних: спектроскопічні, хроматографічні, електрохімічні. Дані, отримані за допомогою двовимірних методів, можна представити у вигляді кривої на площині. При цьому одна (вертикальна) вісь координат цієї площини відповідає величині (інтенсивності) аналітичного сигналу. Друга (горизонтальна) вісь у спектроскопії відповідає довжині хвилі (або енергії фотонів), в хроматографії – часу, в електрохімічних методах – потенціалові або силі струму. Шляхом поєднання двовимірних методів аналізу можна отримати трьох-і багатовимірні методи. Зазвичай криві, отримані за допомогою двовимірних методів, містять окремі піки (хроматографія, електрохімічні методи) або смуги (спектроскопія). Положення максимуму піка або смуги дає якісну інформацію про природу відповідного елемента або сполуки. Висота або площа піку (смуги) несе кількісну інформацію і використовується для визначення змісту відповідного компонента.
Отже, якщо при певних умовах який-небудь параметр аналітичного сигнала залежить від виду досліджуваної речовини і не залежить від його вмісту в пробі, такий параметр сигнала може бути використаний для якісного аналізу. Для кількісного аналізу використовується параметр аналітичного сигнала, який залежить від кількості або від концентрації речовини.
4. Обробка аналітичного сигнала. Для одержання результату аналізу аналітичний сигнал відповідним чином необхідно обробити.
В хімічних методах якісного аналізу візуальне спостереження аналітичного сигнала дозволяє зразу зробити висновок про наявність або відсутність певної речовини. В кількісному хімічному аналізі результати аналізу розраховують за нескладними формулами, використовуючи величини виміряні в п.3.
У ФХМА величина параметрів аналітичного сигнала залежить не тільки від хімічного складу проби, але і від низки факторів, при яких проводяться процеси 2 і 3. Частина цих факторів (ui) контролюється і природа їх впливу на аналітичний сигнал відома. Інша частина (vi) не контролюється і природа їх дії може бути не відома.
 (1.1)
(1.1)
До контрольованих фокторів можуть належати температура, pH середовища, об'єм або маса проби, тощо. Неконтрольованими факторами можуть бути наявність невідомих домішок, зміна характеристики самого вимірювального приладу, тощо. Неконтрольовані фактори зумовлюють випадкові похибки результату аналізу і визначають його відтворюваність.
Обробка аналітичного сигнала у ФХМА полягає в перетворенні показника прилада y в результат аналізу x.
Процес експериментального визначення залежності параметру аналітичного сигнала від складу проби називається калібруванням (градуюванням). Для визначення вмісту компонента на основі результатів вимірювань необхідно в процесі аналізу хоча б один раз виконати калібрування. Мета калібрування – опис зв'язку між величиною (інтенсивністю) аналітичного сигналу і масою, відносним вмістом або концентрацією визначуваного компонента з допомогою калібрувальної функції – як правило, прямолінійної.
4. В аналітичній практиці найбільше поширення отримали наступні методи прямого кількісного визначення з допомогою фізико-хімічних вимірів:
1) метод прямого або абсолютного калібрування метод калібрувального графіку;
2) метод відносного калібрування або метод внутрішнього стандарту;
3) метод добавок.
Всі вони грунтуються на використанні комплекту стандартів або еталонів– сумішей або зразків з відомим вмістом одного чи декількох визначуваних речовин.
Основні вимогидо комплекту стандартів: однаковий агрегатний стан з обробленим об'єктом аналізу, який поступає в прилад; близькість складу невизначуваних компонентів (матриці) стандарта і зразка; очікуваний вміст компоненту в зразках повинен знаходитися в межах вмісту визначуваних компонентів в комплекті стандартів.
Стандарти можуть виготовлятися в хімічних лабораторіях з чистих реактивів, які відповідають вимогам, що ставляться до речовин первинних стандартів. Склад таких стандартів розраховують, виходячи з точної кількості взятих речовин-стандартів і точної кількості або об'єму стандартів. Інколи комплекти еталонів виготовляють спеціалізовані організації (особливо, якщо об'єкт аналізу твердий або сипучий матеріал). У цьому випадку до комплекту еталонів додається паспорт, який містить відомості про склад окремих еталонів і рекомендації по його застосуванню.
1. Метод прямого або абсолютного калібрування. Цей метод використовується тоді, коли конкретний метод ФХМА дозволяє при одержанні аналітичного сигнала від зразків і еталонів (етап 3) підтримувати постійними в часі величини контрольованих факторів. Тоді функціональна залежність аналітичного сигнала буде мати вигляд:
y =f (x), ui = const, (1.2)
і з допомогою комплекту стандартів можна знайти функціональну залежність параметра аналітичного сигнала (yj) від вмісту визначуваного компонента в стандартах (xj), де j - порядковий номер еталона). Цю залежність будують у вигляді графіка в координатах y - x (калібрувальний графік), або виражають в аналітичному вигляді за допомогою математичних методів (калібрувальна функція). Аналітичний сигнал від досліджуваного зразка одержують при тих же значеннях контрольованих умов і, користуючись калібрувальним графіком або функцією, за виміряним значенням y визначають параметр x (рис 1.2.).

Рис. 1.2. Побудова калібрувального графіка і визначення результата аналізу
в методі прямого (абсолютного) калібрування.
Метод простий і достатньо точний в залежності від того, з якою точністю виконується умова ui = const. Для зменшення похибок, пов'язаних з можливими змінами неконтрольованих параметрів, необхідно проводити процедуру калібрування перед кожною серією аналізів досліджуваних зразків.
Різновидом метода прямого калібрування є метод калібрувальних коефіцієнтів. Досить часто калібрувальний графік є прямою лінією, що проходить через початок координат. Така залежність має простий вигляд x=k∙y. Якщо ця залежність достовірно встановлена за допомогою відповідного комплекту стандартів, немає потреби кожен раз проводити калібрування з використанням всього комплекту. Калібрувальний коефіцієнт можна розрахувати, вимірявши аналітичний сигнал від одного стандарта з більшим вмістом визначуваного компонента:
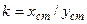 (1.3)
(1.3)
За точністю цей метод не поступається першому, але простіший у використанні. Тому намагаються проводити 3-й етап аналізу в таких умовах, щоб виконувалася пряма пропорційна залежність аналітичного сигнала від концентрації або маси визначуваної речовини у зразку.
2. Метод відносного калібрування або метод внутрішнього стандарта використовується тоді, коли з тих чи інших причин не забезпечується умова постійності в часі контрольованих параметрів (ui ≠ const). Цей метод полягає у тому, що до об'єкта аналізу і еталонів додають постійну кількість речовини-стандарта (внутрішнього стандарта), якої немає в об'єкті аналізу. Вибирають таку речовину і таку її кількість, щоб вплив контрольованих умов на вимірюваний параметр аналітичного сигнала визначуваної речовини і речовини-стандарта був однаковим. Це є необхідною умовою для використання метода відносного калібрування. Однаковий вплив контрольованих умов повинен реалізуватися так, щоб функціональна залежність параметра аналітичного сигналу дорівнювала [PS1] добутку або сумі двох функцій, одна з яких є функція, яка залежить від вмісту визначуваної речовини, друга - від контрольованих умов:
а) 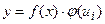
 (1.4) або
(1.4) або
б) 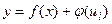
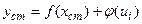 (1.5)
(1.5)
У випадку а) відношення параметрів аналітичного сигнала визначуваної речовини і речовини стандарта не буде залежати від параметрів роботи приладу (ui). При постійному вмісті речовини-стандарта в еталонах і зразках (xст = const) відносний параметр аналітичного сигнала r = y/yст буде залежати тільки від вмісту визначуваної речовини в зразках:
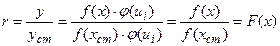 (1.6)
(1.6)
У випадку б) відносний параметр аналітичного сигнала дорівнює різниці аналітичних сигналів визначуваної речовини і речовини-стандарта:
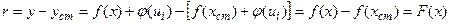 (1.7)
(1.7)
Результат аналізу одержують як в пункті 1, використовуючи залежність відносного параметру аналітичного сигнала r від визначуваної величини x.
Цей метод обробки аналітичного сигнала більш трудомісткий ніж метод абсолютного калібрування, бо вимагає додаткової операції додавання речовини внутрішнього стандарта і одночасного фіксування двох аналітичних сигналів з наступним розрахунком відносного аналітичного сигнала, але дозволяє при нестабільності контрольованих умов одержати результати аналізу, близькі за точністю до метода абсолютного калібрування.
Якщо об'єкт аналізу становить основну речовину з невеликою кількістю домішок, при визначенні кількості домішок методом відносного калібрування за речовину-стандарт доцільно взяти основний компонент зразка, концентрація якого змінюється незначно і може вважатися постійною. У цьому випадку аналіз спрощується за рахунок відсутності операції спеціального додавання речовини-стандарта.
Різновидом методу внутрішнього стандарту є метод добавок. У цьому методі як речовину-стандарт беруть визначувану речовину, відому кількість якої додають до відміряної кількості об'єкта аналізу.
Процедура методу полягає в тому, що спочатку вимірюють аналітичний сигнал від об'єкта аналізу. Потім проводять серію вимірювань аналітичного сигналу від сумішей об'єкта аналізу з різними відомими добавками чистої визначуваної речовини або її розчину відомої концентрації. Екстраполяція залежності аналітичного сигналу від кількості добавленої речовини до нульового значення аналітичного сигналу (рис. 1.3.) дає можливість визначити вміст аналізованої речовини в зразку.
Оскільки при нелінійності калібрувальної функції екстраполяція може привести до значної помилки результату аналізу, звичайно цей метод використовують при прямій пропорційній залежності аналітичного сигналу. У цьому випадку точність методу задовільна і можна використати аналітичний розрахунок результату аналізу.

Рис. 1.3. Визначення результату аналізу методом добавок.
Припустимо, що аналітичний сигнал від проби з концентрацією сx є yx . При лінійній залежності:  . (1.8)
. (1.8)
Якщо підготовку проби організувати так, щоб після додавання чистої речовини концентрація визначуваної речовини в пробі збільшилася на сст, одержимо:
 . (1.9)
. (1.9)
З цих двох рівнянь можна визначити результат аналізу:
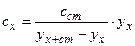 . (1.10)
. (1.10)
Якщо до зразка об'єму Vx додають стандартний розчин об'ємом Vст з концентрацією речовини сст і одержують аналітичний сигнал yx+ст, результат аналізу розраховують за формулою:
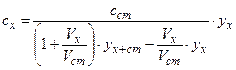 , (1.11),
, (1.11),
яка враховує зменшення концентрації визначуваної речовини від збільшення об'єму внаслідок додавання стандарту.
Для забезпечення однакових умов впливу складу матриці на аналітичний сигнал необхідно, щоб об'єм стандарта був набагато меншим ніж об'єм проби (Vст « Vx). Якщо ця умова виконується, то з достатньою точністю можна користуватися спрощеною формулою:
 (1.12)
(1.12)
Звичайно намагаються готувати стандарт з такою концентрацією сст, щоб при обраному об'ємі стандарту (Vст), аналітичний сигнал збільшувався приблизно вдвоє, тобто yx+ст ~ 2yx .
Метод добавок дозволяє одержувати достатньо точні результати при концентраціях речовин, які лежать на межі виявлення.
5. У всіх розглянутих способах використовують зразки порівняння (еталони). Методи аналізу, які використовують еталони – це так звані відносні методи хімічного аналізу. Методи, які грунтуються на фізичних явищах, як правило, є відносними і потребують калібрування. Абсолютних методів в аналітичній хімії небагато – ті, в яких концентрацію визначають за допомогою фундаментальних фізичних постійних і законів, таких як молярні маси і співвідношення стехіометрії в гравіметрії і титриметрії, постійна Фарадея і закони електролізу в кулонометрії. Абсолютні методи не потребують калібрування.
У методах титрування ФХМА в ході титрування вимірюється інтенсивність аналітичного сигналу у і будується крива титрування в координатах у-V, де V – об’єм доданого титранту, мл. Точка еквівалентності знаходиться за кривою титрування. Вигляд кривих титрування може бути різний через те, що інтенсивність аналітичного сигналу по-різному залежить від концентрації визначуваної речовини, титранта чи продукту реакції. Для визначення точки еквівалентності необхідно вибрати для вимірювання такий параметр розчину, щоб на кривій титрування у точці еквівалентності був помітний стрибок, злам або різка зміна кута нахилу прямих чи дотичних до кривих. Для точнішого фіксування точки еквівалентності, інколи будують залежність від об'єму титранту не самого аналітичного сигналу, а його першої або другої похідної.
Точність вимірювальних приладів та процедури калібрування не перевищує 1-2% відносних, тому відносна похибка результатів аналізів, виконаних інструментальними методами, не може бути меншою декількох процентів, за винятком деяких методів, у яких можливе використання приладів вищого класу точності.
– Конец работы –
Эта тема принадлежит разделу:
Тема 1. Введення в фізико-хімічні методи аналізу
ТЕМА РЕФРАКТОМЕТРИЧНИЙ МЕТОД АНАЛІЗУ... Метод що рунтується на вимірюванні показника заломлення називається рефрактометричним...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Тема 1. Введення в фізико-хімічні методи аналізу.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов