рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Характеристика і діапазони електромагнітного випромінювання
Реферат Курсовая Конспект
Характеристика і діапазони електромагнітного випромінювання
Характеристика і діапазони електромагнітного випромінювання - раздел Философия, Тема 1. Введення в фізико-хімічні методи аналізу СпектроскопічнимиМетодами Аналізу Називаються Методи, Заснов...
Спектроскопічнимиметодами аналізу називаються методи, засновані на взаємодії речовини (в даному випадку – аналізованого зразка) з електромагнітним випромінюванням.
Електромагнітне випромінювання являє собою вид енергії, яка поширюється у вакуумі зі швидкістю близько 300 000 км/с і яка може виступати у формі світла, теплового та ультрафіолетового випромінювання, мікро-і радіохвиль, гамма-та рентгенівських променів (табл.2.1).
З курсу фізики відомо, що електромагнітне випромінювання має подвійну природу. Одні властивості електромагнітного випромінювання зручніше описувати, виходячи з його хвильової природи, інші – з корпускулярної.
Закономірності розповсюдження, дифракції та інтенференції випромінювання описуються хвильовою теорією, згідно з якою світло є електромагнітною хвилею, яка поширюється у вигляді поперечної хвилі. Коливання відбуваються в напрямках, перпендикулярних напрямку поширення (хвильова природа випромінювання проілюстрована на рис. 2.1.)
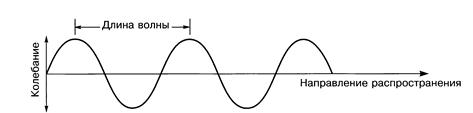
Рис. 2.1. Поширення хвиль електромагнітного випромінювання
Закономірності випромінювання і поглинання описуються квантовою теорією, яка розглядає випромінювання як потік матеріальних частинок – фотонів.
Характеристиками електромагнітного випромінювання з хвильової точки зору (як класичної синусоїдальної хвилі) є довжина хвилі (λ) і частота (ν), які пов'язані співвідношенням:
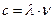 (2.1),
(2.1),
де с – швидкість розповсюдження електромагнітного випромінювання.
Довжинихвиль електромагнітного випромінювання охоплюють діапазон від кількох ангстремдо кількох метрів. Для них використовуються наступні одиниці вимірювання:

Довгі хвилі можуть вимірюватися в метрах, сантиметрах, міліметрах (1мм=10-3 м), а короткі – в мікрометрах (мікронах), нанометрах (мілімікронах), ангстремах. Наприклад, довжини хвиль УФ- і видимого випромінювання вимірюються в нанометрах, ІФ-випромінювання – в мікрометрах.
Величина, обернена до довжини хвилі пропорційна до частоти і називається хвильовим числом: N = ν' = 1/λ = ν/с. Хвильове число показує кількість довжин хвиль, які вміщуються на довжині 1 см і має розмірність см -1.
Частота являє собою число коливань електричного поля за одну секунду, вона залежить тільки від природи джерела випромінювання. Частота має розмірність с-1, яка називається герц (Гц). Використовуються кратні величини: мегагерц (1мГц = 106 Гц), гігагерц (1гГц = 1012 Гц).
Швидкість же розповсюдження електромагнітних хвиль а, отже, і довжина хвилі залежать також і від властивостей середовища. Швидкість поширення електромагнітного випромінювання у вакуумі є фундаментальною фізичною сталою, званою швидкістю світла і рівна 2,997925∙108 м / с. У повітрі швидкість світла зменшується приблизно на 0,03%. Для практичних цілей можна прийняти значення швидкості світла 3∙108 м / с. Зв'язок швидкості світла, довжини хвилі і частоти випромінювання описує вище наведене співвідношення.
Електромагнітне випромінювання володіє енергією. Згідно корпускулярної теорії електромагнітне випромінювання розуміють як потік частинок (фотонів, квантів світла), що характеризуються певною енергією (Е), яка вимірюється в джоулях (Дж). Зв'язок енергії фотона з хвильовими характеристиками електромагнітних коливань описується співвідношенням, виведеним Ейнштейном:
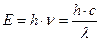 (2.2),
(2.2),
де h – постійна Планка або квант дії, фундаментальна фізична стала (6,62 ∙ 10-34 Дж∙с).
Очевидно, що чим менша довжина хвилі або більша частота, тим вища енергія. Ось чому УФ-випромінювання сонця обпікає нас!
Таким чином, енергія одного фотона прямо пропорційна частоті і звортньопропорційна довжині хвилі електромагнітного випромінювання.
Для 1 моля речовини:
E = 6,62∙10-34∙6,02∙1023∙ν = 3,99∙10-10∙ν (Дж/моль).
Таким чином λ, ν або E однозначно характеризують вид електромагнітного випромінювання. Знаючи одну з цих величин можна за формулами 2.1 і 2.2 розрахувати дві інші.
Електромагнітне випромінювання характеризується ще однією величиною – потужністю потоку випромінювання (Дж/с), яку називають інтенсивністю І. З точки зору хвильової теорії інтенсивність визначається амплітудою електричного і магнітного полів певної частоти коливань. З точки зору корпускулярної теорії інтенсивність дорівнює кількості фотонів певної енергії, які випромінюються за секунду.
Взаємодія світла з речовинами – це взаємодія світлового електромагнітного поля, що коливається з високою частотою, з електронами, атомами і молекулами речовин, знаходяться в цьому полі. Найбільш повно таку взаємодію описує квантова механіка.
Проходження світла через оптично густе середовище (наприклад, повітря) супроводжується взаємодією випромінювання з валентними електронами атомів молекул речовини, внаслідок чого швидкість поширення випромінювання зменшується. Оскільки частота випромінювання при цьому залишається постійною, довжина хвилі змінюється. Приклад, наведений на рис. 2.2, показує, що при переході видимого випромінювання з повітря в скло довжина хвилі зменшується приблизно на 200 нм.

Рис. 2.2. Зміна довжини хвилі монохроматичного випромінювання при проходженні в склі
Зменшення швидкості світла при проходженні його через середовище речовини пояснюється періодичною поляризацією атомів або молекул середовища. При цьому частина енергії випромінювання поглинається середовищем і через приблизно 10-14 с з вивільняється в тій же кількості.
Уявлення про корпускулярну природу електромагнітного випромінювання необхідне для описання процесів поглинання і випускання світла.
При поширенні через поглинаюче середовище електромагнітна хвиля взаємодіє з речовиною, змінюючи її енергетичний стан. Ця взаємодія відбувається шляхом поглинання речовиною фотонів – квантів енергії світлової хвилі. Під час поглинання окремий атом, йон чи молекула, взаємодіючи з фотоном, збільшує свою енергію на величину, рівну енергії фотона, і переходить із основного енергетичного стану у збуджений. Згідно квантової теорії, можливі енергетичні стани частинки дискретні і визначаються природою частинки, її оточенням і фізичним станом речовини. Процеси поглинання світла окремим атомами і молекулами протікають по-різному, що буде розглянуто пізніше при вивченні відповідних методів аналізу. Таким чином, при кожному акті поглинання фотона внутрішня енергія речовини збільшується дискретно – на величину енергії кванта світла.
Випускання випромінювання спостерігається тоді, коли частинка, яка перебуває у збудженому стані, переходить в стан з меншою енергією. При цьому надлишок енергії вивільняється у вигляді фотона. Для переведення частинки в збуджений стан можна використовувати поглинання випромінювання від зовнішнього джерела, високу температуру (в полум'ї або плазмі), бомбардування електронами або іонами і інші методи.
Сукупність всіх частот (довжин хвиль) електромагнітного випромінювання називають електромагнітним спектром. Діапазон електромагнітного спектру простягається від найбільш довгохвильового випромінювання – радіохвиль з довжиною хвиль більше 0,1 см, до найбільш високоенергетичного γ-випромінювання з довжинами хвиль порядка 10-11 м.
Цей діапазон довжин хвиль розбивають на області (табл. 2.1.). Область електромагнітного випромінювання, що сприймається людським оком – видиме світло, дуже незначна порівняно з усім його діапазоном, і займає вузьку область 400-750 нм.
 Табл. 2.1. Області електромагнітного спектру
Табл. 2.1. Області електромагнітного спектру
З окремими областями електромагнітного спектра пов'язані різні методи
аналізу. У табл. 2.2 наведено огляд цих методів у взаємозв'язку з відповідними спектральними діапазонами і характером процесів, що протікають при взаємодії випромінювання з речовиною.
Крім класифікації за типом електромагнітного випромінювання спектроскопію можна класифікувати за рядом інших ознак:
1. За характером взаємодії випромінювання з речовиною спектроскопію ділять на спектроскопію поглинання (абсорбційна), випускання (емісійна), розсіювання (комбінаційного розсіювання) і відбивання (спектроскопія відбивання)
2. За досліджуваними об'єктами спектроскопію поділяють на атомну і молекулярну.
3. За способом реєстрації спектру методи ділять на візуальні, фотографічні та фотоелектричні.
Предметом нашого першого розгляду будуть спектроскопічні оптичні молекулярно-абсорбційні методи аналізу, які використовують електромагнітне випромінювання оптичного діапазону, що охоплює довжини хвиль (10-1×106 нм) і складається з ультрафіолетової, видимої і інфрачервоної областей (табл. 2.3.). Це випромінювання пов'язане з процесами, які відбуваються з участю зовнішніх (оптичних, валентних) електронів атомів, і з просторовою будовою молекул.
Табл. 2.2. Взаємозв’язок спектроскопічних методів
і областей електромагнітного спектру
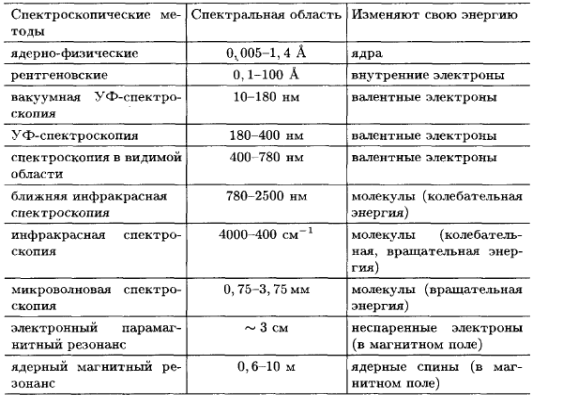
Табл. 2.3. Оптичний діапазон електромагнітного випромінювання (нм)
| Ультрафіолетова область - Вакуумна - Дальня - Ближня | 10 – 400 10 – 185 185 – 230 230 – 400 |
| Видима - Фіолетовий - Синій - Голубий - Зелений - Жовтий - Оранжевий - Червоний | 400 – 750 390 – 420 420 – 455 455 – 494 494 – 565 565 – 595 595 – 640 640 – 750 |
| Інфрачервона - Ближня - Дальня | 750 – 106 750 – 25·103 25·103 – 106 |
Яким чином речовина поглинає випромінювання? Ми бачимо об'єкти забарвленими, тому що вони пропускають або відбивають тільки частину видимого спектру. Коли поліхроматичне випромінювання (біле світло), яке містить весь спектр довжин хвиль із видимого діапазону, проходить через прозорий об'єкт, останній поглинає випромінювання певних довжин хвиль і пропускає інше. Це пройшовше через об'єкт випромінюванні і сприймається як світло. Аналогічно, непрозорі об'єкти поглинають частину випромінювання і відбивають іншу, яка і створює колір об'єкту. На рис. 2.3. показано, як співвідносяться кольори, які ми бачимо, з довжиною хвилі випромінювання. Наприклад, розчин перманганату калію поглинає зелений колір з максимумом 525 нм, а ми бачимо його фіолетовим.

Рис. 2.3. Кольори і інтервали довжин хвиль у видимій області спектру
Випромінювання, яке складається з електромагнітних коливань певної довжини хвилі називається монохроматичним. У природі монохроматичне випромінювання зустрічається рідко. Зазвичай випромірювання складається з електромагнітних коливань різних довжин хвиль. Звичайний потік випромінювання від розжарених тіл, який ми можемо спостерігати, зокрема сонячне світло, є поліхроматичним.
– Конец работы –
Эта тема принадлежит разделу:
Тема 1. Введення в фізико-хімічні методи аналізу
ТЕМА РЕФРАКТОМЕТРИЧНИЙ МЕТОД АНАЛІЗУ... Метод що рунтується на вимірюванні показника заломлення називається рефрактометричним...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Характеристика і діапазони електромагнітного випромінювання
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов