рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Атом водорода и одноэлектронные частицы
Реферат Курсовая Конспект
Атом водорода и одноэлектронные частицы
Атом водорода и одноэлектронные частицы - раздел Химия, Химическая связь и строение вещества Для Атома Водорода Уравнение Шрёдингера Решается Точно. ...
Для атома водорода уравнение Шрёдингера решается точно.
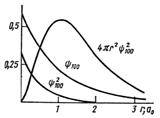 Рис. 3. Зависимость 1s‑волновой функции, ее квадрата и вероятности нахождения электрона в атоме Н от расстояния до ядра
Рис. 3. Зависимость 1s‑волновой функции, ее квадрата и вероятности нахождения электрона в атоме Н от расстояния до ядра
|
Приведем (для примера, а не для запоминания) конкретный вид Y‑функции для значений квантовых чисел n = 1, ℓ = 0, m = 0 для атома водорода: Y100(r) = (p)‑0,5(a0)‑1,5e‑r/a0, где r – расстояние от ядра (точка с координатами (x, y, z)), a0 = h/4πmeee2 = 0,53·10‑10 м – боровский радиус (в честь Н. Бора), h =6,63·10‑34 Дж·с – постоянная Планка, me и ee – масса и заряд электрона соответственно.
Как уже упоминалось, вероятность обнаружения электрона пропорциональна Y2, а именно W(r)dr = = 4pr2Y2dr (сомножитель 4pr2, равный площади этой сферы, появляется потому, что речь идёт о нахождении электрона в бесконечно тонком сферическом слое между r и dr). На рис. 3 представлены графики функции Y100, ее квадрата (Y100)2 и величины W(r). Величина W(r) для Y100 в атоме Н имеет максимум на расстоянии боровского радиуса a0 = 0,53 Å от ядра – именно на таком расстоянии электрон наблюдается чаще всего. Вместе с тем, хотя W(r) уменьшается с удалением от ядра, она не обращается в 0, а лишь стремится к 0 при r ® ∞. Таким образом, электронное облако не имеет четко очерченных границ. Имеет ли тогда смысл понятие «размер атома»? Да, хотя и условный. Можно рассматривать некоторый объем вокруг ядра, содержащий, например, 90 или 99 % электронной плотности.
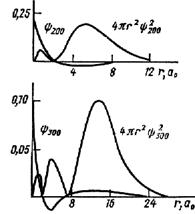 Рис. 4. Зависимость волновой функции и вероятности нахождения электрона в атоме Н от расстояния до ядра для 2s- и 3s-АО
Рис. 4. Зависимость волновой функции и вероятности нахождения электрона в атоме Н от расстояния до ядра для 2s- и 3s-АО
|
В случае Y100 для атома Н 90 % электронной плотности оказывается заключенной внутри сферы радиусом r = 2,65 a0 = 1,40 Å. Хотя это значение условно, его можно использовать для сравнения с размером других атомов, понимаемым в том же смысле (хотя численные значения будут зависеть от того, какую долю электронной плотности рассматривают для характеристики размеров атома).
С увеличением главного квантового числа n волновые функции усложняются. Например, для Y200 = (4)‑1(2p)‑0,5(a0)–1,5[2‑(r/a0)]e‑r/2a0 функция меняет знак с «+» на «–», что приводит к возникновению двух максимумов W(r). Наибольший из них отодвигается от ядра до r » 5a0 (для y1s r = a0, см. рис. 3), эффективный размер атома Н увеличивается. Остальные s‑АО при увеличении r меняют знак n–1 раз, и чем больше n, тем дальше от ядра (в среднем) находится электрон (рис. 4).
С увеличением n и удалением электрона от ядра уменьшается сила его притяжения к ядру и энергия, зависящая только от главного квантового числа:
En = –C/n2.(4)
Здесь En – энергия электрона, n – главное квантовое число, константа C = meee4/8e0h2 =13,6 эВ, остальные обозначения определены выше. Уравнение (4) следует осмыслить и запомнить, так как оно является одной из основ понимания электронного строения атома. Значение Е = 0 обычно приписывают энергии невзаимодействующих ядра (протона) и электрона. Энергия электрона в атоме Н отрицательна! Как уже говорилось, выделяющаяся энергия отрицательна, затрачиваемая – положительна. Для системы из протона и электрона энергетически выгодно образовать атом.
Значения энергии для соответствующих АО называют энергетическими уровнями, En,ℓ, графическое изображение энергетических уровней – энергетическими диаграммами (на энергетических диаграммах имеется только вертикальная ось – энергии). Хотя из перечисленных выше взаимосвязей между квантовыми числами видно, что количество АО бесконечно, набор АО дискретен: квантовые числа n, ℓ, m– целые и изменяются дискретно. Соответственно имеется набор разрешенных значений энергии электрона в атоме, En,ℓ. Остальные значения энергии запрещены.
Энергетическая диаграмма для атома Н приведена на рис. 5. Состояние атома с минимальной энергией называется основным, все остальные – возбужденными. Для атома Н основное состояние –y100, или электрон на 1s‑АО, 1s1, энергия электрона (и покоящегося атома в целом) из уравнения (4) E1 = –C/12 = –13,6 эВ.
 Е H+ + e - свободный, не связанный с ядром электрон
¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ E = 0
и т. д.; здесь уровни располагаются все ближе друг к другу; Е6 и т. д.
5s ¾ 5p ¾ ¾ ¾ 5d ¾ ¾ ¾ ¾ ¾ 5f ¾ ¾ ¾ ¾ ¾ ¾ ¾ 5g ¾ ¾ ×× Е5
4s ¾ 4p ¾ ¾ ¾ 4d ¾ ¾ ¾ ¾ ¾ 4f ¾ ¾ ¾ ¾ ¾ ¾ ¾ Е4= -0,9 эВ
3s ¾ 3p ¾ ¾ ¾ 3d ¾ ¾ ¾ ¾ ¾ Е3 = -1,5 эВ
2s ¾ 2p ¾ ¾ ¾ Е2 = -3,4 эВ
1s ¾ основное состояние Е1 = -13,6 эВ
Рис. 5. Энергетическая диаграмма атома H (масштаб не соблюден) Е H+ + e - свободный, не связанный с ядром электрон
¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ E = 0
и т. д.; здесь уровни располагаются все ближе друг к другу; Е6 и т. д.
5s ¾ 5p ¾ ¾ ¾ 5d ¾ ¾ ¾ ¾ ¾ 5f ¾ ¾ ¾ ¾ ¾ ¾ ¾ 5g ¾ ¾ ×× Е5
4s ¾ 4p ¾ ¾ ¾ 4d ¾ ¾ ¾ ¾ ¾ 4f ¾ ¾ ¾ ¾ ¾ ¾ ¾ Е4= -0,9 эВ
3s ¾ 3p ¾ ¾ ¾ 3d ¾ ¾ ¾ ¾ ¾ Е3 = -1,5 эВ
2s ¾ 2p ¾ ¾ ¾ Е2 = -3,4 эВ
1s ¾ основное состояние Е1 = -13,6 эВ
Рис. 5. Энергетическая диаграмма атома H (масштаб не соблюден)
|
Следующие по энергии состояния – y2,0,0, y2,1,0, y2,1,-1, y2,1,1 или 2s, 2px, 2py, 2pz, для n = 2. Для них E2 = –C/22 = –3,4 эВ и т. д. Чем больше n, тем меньше различия в энергии соседних уровней, они «сгущаются» и при больши́х n практически сливаются. Состояние с n = ¥ соответствует уже не связанному с ядром электрону.
Итак, с увеличением главного квантового числа электрон удаляется от ядра, становится менее прочно связанным с ним, его энергия увеличивается. Теперь рассмотрим влияние на состояние электрона азимутального числа ℓ.
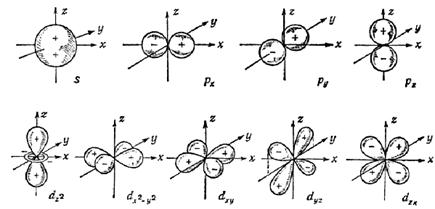 |
Рис. 6. Схематическая форма электронных облаков 1s-, 2р- и 3d-АО.
Плюсы и минусы означают знаки волновых функций
Атомные орбитали с различными значениями ℓ отличаются симметрией (формой) распределения электронной плотности, или, как говорят для большей наглядности, пространственной формой электронных облаков (рис. 6), что имеет важнейшее значение для понимания геометрии молекул.
Все s‑орбитали сферические, их электронная плотность при постоянном расстоянии от ядра r не зависит от направления.
Все р-облака вытянуты вдоль осей x, y, z, их электронная плотность (а также d-, f- и остальных) зависит не только от r, но и от направления (см. рис. 6). Значения y2p меняют знак при прохождении через начало координат, электронная плотность имеет максимум при некотором r > a0 и убывает до 0 при r = 0 и r®¥ и при изменении направления до экваториальной плоскости (рис. 7). Например, для двух «лепестков» 2px‑АО (см. рис. 6) значения y‑функции противоположны: положительные для х > 0 и отрицательные для х < 0.
Форма 3d-орбиталей еще сложнее, их количество равно пяти, они различны по симметрии: 3dxz, 3dyz, 3dxy, 3dx2-y2 эквивалентны (3dx2-y2 повёрнута на 45° относительно 3dxy), 3dz2 отличается от них (см. рис. 6). Распределение электронной плотности ,W(r), для 3d-АО показано на рис. 7.
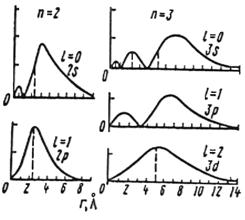 Рис. 7. Зависимость W(r) от расстояния до ядра в атоме Н для 2s, 2p, 3s, 3p и 3d-АО
Рис. 7. Зависимость W(r) от расстояния до ядра в атоме Н для 2s, 2p, 3s, 3p и 3d-АО
|
Ещё сложнее семь f‑орбиталей и т. д. Симметрия АО с одинаковыми ℓ одинакова для всех n (2px, 3px, 4px-АО и т. д. вытянуты вдоль координатной оси х, все nру – вдоль оси у и т. п.). Запомнить форму АО помогает мнемоническое правило: s-АО – сферические, р – перпендикулярные, d – диагональные.
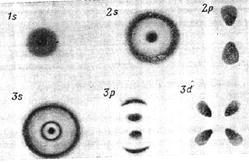 Рис. 8. Вид электронного облака атома Н для различных АО
Рис. 8. Вид электронного облака атома Н для различных АО
|
Чем больше значение n, тем дальше располагается электрон от ядра (в среднем) и тем слабее к нему притягивается и, следовательно, тем выше энергия электрона на соответствующей орбитали (иногда говорят об энергии самой орбитали, что не совсем точно, так как орбиталь – абстрактное понятие и без электрона не обладает ни энергией, ни другими физическими характеристиками).
Для данного значения n размер электронного облака растет с увеличением ℓ. Изменение числа m влияет только на ориентацию электронного облака; и только при наличии магнитного поля энергия электрона зависит от m. Картинки распределения электронной плотности в пространстве для различных АО атома водорода приведены на рис. 8.
Возможно изменение состояния электрона в атоме (по другой терминологии, переход электрона с одного энергетического уровня на другой). При этом (как и при любом другом процессе!) должен выполняться закон сохранения энергии. Чтобы перевести электрон в атоме Н из состояния 1s в состояние 2s или 2p, требуется затратить DЕ1,2 = Е2 – Е1 =–3,4 –(–13,6) = 10,2 эВ. При обратном процессе эти ‑10,2 эВ, согласно уравнению Планка (1), выделяются в виде фотона (кванта света) с частотой n = DЕ/h. И наоборот, при поглощении фотона с частотой n ³ DЕ/h возможен переход электрона на более высокий энергетический уровень.
Подчеркнем, что для атома водорода энергия электрона зависит только от главного квантового числа n и не зависит от ℓ.
Так же, как атом водорода, устроены другие одноэлектронные (водородоподобные) частицы – He+, Li2+, Be3+ и т. д. Отличие их от Н состоит в большем заряде ядра, Ze, и, следовательно, более сильном притяжении электрона к ядру. Вследствие этого зависимость энергии электрона в таких частицах выражается уравнением (5)
En = –Z2C/n2, (5),
отличающемся от уравнения (4) для водорода на множитель, равный квадрату заряда ядра Z.
Казалось бы, что, кроме атома Н, остальные одноэлектронные частицы не представляют особого интереса для химии. Но, не разобравшись в этом простом случае, трудно будет понять закономерности электронного строения реальных многоэлектронных атомов и ионов. Энергетическая диаграмма Не+ приведена на рис. 9.
Для Не+, согласно уравнению (4), Е1 = –13,6 · (22)/12 = –54,4 эВ; для Li2+, Е1 = –13,6 · (32)/12 = –122,4 эВ и т. д. – чем больше заряд ядра, тем прочнее связан с ядром электрон, тем меньше среднее удаление электрона от ядра (эффективный размер электронного облака), тем глубже расположены энергетические уровни. Итак, в одноэлектронных частицах имеется только одно взаимодействие – притяжение электрона к ядру, уравнение Шрёдингера решается точно. Состояние электрона в таких частицах полностью описывается волновой функцией (атомной орбиталью), задаваемой квантовыми числами (n, ℓ, m, ms). Энергия электрона зависит только от n и не зависит от ℓ и остальных квантовых чисел. Электрон на орбиталях (2, 0, 0), т. е. 2s, и (2, 1, 0), т. е. 2p, имеет одинаковую энергию (располагается на том же энергетическом уровне). Последовательность увеличения энергии для одноэлектронных частиц проста, понятна и красива:
1s < 2s = 2p < 3s = 3p = 3d < 4s = 4p = 4d = 4f < 5s = 5p…и т. д. (см. рис. 4 для Н; рис. 9 для Не+), причём разница в энергии между соседними энергетическими уровнями уменьшается с ростом n.
| Не2+ + 2е Не+ + е ¾¾¾¾¾¾¾¾¾¾¾¾¾ Е = 0 ¾¾¾¾¾¾¾ Е = 0 6s ¾ 6p ¾ ¾ ¾ 6d ¾ ¾…6f ¾…6g ¾…6h ¾ 3d ¾ ¾ ¾ ¾ ¾ E3d 5s ¾ 5p ¾ ¾ ¾ 5d ¾ ¾…5f ¾…5g ¾… Е5= –2,2 3p ¾ ¾ ¾ E3p 3s ¾ E3s 4s ¾ 4p ¾ ¾ ¾ 4d ¾ ¾…4f ¾ … Е4 = –3,4 2p ¾ ¾ ¾ E2p = –3,6 2s ¾ E2s = –4,3 3s ¾ 3p ¾ ¾ ¾ 3d ¾ ¾ ¾… Е3= –6,0 2s ¾ 2p ¾ ¾ ¾ Е2= –13,6 основное состояние Не 1s2 ¾¯¾ Е1s = –24,6 1s ¾¾ основное состояние Не+ Е1= –54,4 Не+ He Рис. 9. Энергетическая диаграмма системы Не2+ + 2е. Слева – энергетические уровни для одноэлектронного иона Не+; справа – уровни второго е для атома Не (первый е находится на 1s‑АО). Масштаб не соблюдён, все значения энергии в эВ |
При больши́х n энергетические уровни практически сливаются, впрочем, эти состояния не представляют интереса: что на 2003s-АО, что на 2004s-АО электрон практически не связан с ядром, это почти свободный электрон.
Иная ситуация характерна для многоэлектронных частиц.
Вопросы для самопроверки
1. Дайте буквенные обозначения АО для y400 и y530.
2. Перечислите все возможные АО для n = 6.
3. Почему не существует 1p, 2d, 3f-АО?
4. Сколько р-АО возможно для n = 5?
5. Какая энергия требуется для перехода электрона в атоме водорода из основного состояния на 3р-АО?
6. Энергия какого перехода в атоме Н больше – с n = 3 на n = 4 или с n = 2003 на n = 2004?
7. В каком состоянии атом Н имеет бóльший размер – в основном или в возбужденном?
8. Какая частица имеет бóльший размер – Н или Не+?
9. Во сколько раз энергия Na10+ меньше энергии H?
– Конец работы –
Эта тема принадлежит разделу:
Химическая связь и строение вещества
На сайте allrefs.net читайте: "Химическая связь и строение вещества"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Атом водорода и одноэлектронные частицы
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов