рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Нейтральные атомы в основном состоянии
Реферат Курсовая Конспект
Нейтральные атомы в основном состоянии
Нейтральные атомы в основном состоянии - раздел Химия, Химическая связь и строение вещества Принцип Паули Может Быть Переформулирован: На Одной Атомной Орбитали ...
Принцип Паули может быть переформулирован: на одной атомной орбитали может размещаться не более двух электронов с разными спиновыми числами – такую АО называют заполненной, электроны на ней – спаренными. Атомная орбиталь, содержащая один электрон, называется полузаполненной (частично заполненной), электрон – неспаренным. Незаполненная электронами АОназывается вакантной.
Ещё раз напомним условность терминологии: АО – не орбита, по которой вращается электрон, как Земля вокруг Солнца, не некоторое пространство вокруг ядра, в котором «размещается» электрон, а абстрактное понятие, математическая y‑функция, три значения квантовых чисел (n, ℓ, m), полностью характеризующие энергию и другие свойства электрона. Но сложившаяся терминология именно такова: говорят о нахождении электронов на АО, заселении орбиталей электронами и т. п.
Количество электронов на энергетическом уровне с данным ℓ обозначают индексом справа вверху от символа АО. Убедитесь самостоятельно, рассмотрев все допустимые значения квантовых чисел, что всего в атоме может находиться не более двух электронов с n = 1 (единственное разрешенное значение ℓ = 0 и m = 0); не более восьми электронов для n = 2; не более 18 для n = 3 и вообще не более 2n2 для произвольного n. Максимальное количество электронов с определённым ℓ для каждого электронного слоя составляет ns2, np6 (n ³ 2), nd10 (n ³ 3), nf14 (n ³ 4) и т. д.
Электроны с одинаковым значением n называют электронным слоем. Можно сказать (хотя и с оговорками), что такие электроны действительно чаще находятся в некотором слое, описанном вокруг ядра, или, согласно другому подходу, образуют слой электронной плотности вокруг ядра. Однако не следует забывать, что электронное облако не имеет точно очерченных границ. Исторически сложились буквенные обозначения электронных слоёв:
| Главное квантовое число n | 7 и т. д. | ||||||
| Обозначение электронного слоя | K | L | M | N | O | P | Q |
Энергетические уровни с одинаковым ℓ называют подуровнями (2р-подуровень, d-подуровни и т. п.).
Заполнение орбиталей электронами происходит согласно двум основополагающим законам природы – принципу наименьшей энергии и принципу Паули.
Согласно первому принципу, заселение АО электронами начинается с орбитали, имеющей самую низкую энергию (1s), затем последовательно, по мере повышения их энергии, заполняются остальные АО (расположение энергетических уровней определяется правилом n + ℓ и приведено на рис. 11).
Основным состоянием одноэлектронных частиц будет состояние с n = 1 и ℓ = 0, т. е. электрон на 1s-орбитали.
Электроны в атоме подчиняются также правилу Гунда, гласящему, что заселение АО электронами происходит таким образом, чтобы при выполнении принципов минимума энергии и Паулисуммарный спин атома был максимальным(правило Гунда справедливо только для основного состояния частиц и может нарушаться для возбужденных состояний).
Совокупность заполненных (полностью или частично) атомных орбиталей частицыназывается её электронной конфигурацией.
Электронные конфигурации H 1s1, He 1s2, Li 1s22s1, Be 1s22s2, B 1s22s22p1 для основных состояний приведены здесь в виде символов. Для их построения достаточно принципа Паули.
Иная ситуация – для углерода. Четыре электрона второго слоя можно распределить по АО двумя отличающимися по энергии способами. По правилу Гунда у атома С должна быть в основном состоянии конфигурация 1s22s22px1py1 с суммарным спином 1 для валентных электронов (левая схема), а не 1s22s22px2 с суммарным спином 0 (правая), которую нужно рассматривать как одну из возможных возбужденных конфигураций углерода.
Ниже представлена схема квантовых ячеек для атома С.
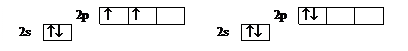 Основное состояние Основное состояние
| Возбужденное состояние |
Схемы в виде квантовых ячеек более информативны и понятны при овладении материалом, из них наглядно видно заполнение АО: какие заполнены полностью, какие – частично, количество неспаренных электронов. Поэтому на начальном этапе изучения рекомендуется при записи электронных конфигураций использовать такую схему и лишь затем, по мере накопления опыта, переходить к символьной записи (хотя во многих случаях и символьная запись даёт однозначное описание состояния электронов в атоме). Для формы изображения квантовых ячеек строгих правил нет.
– Конец работы –
Эта тема принадлежит разделу:
Химическая связь и строение вещества
На сайте allrefs.net читайте: "Химическая связь и строение вещества"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Нейтральные атомы в основном состоянии
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов