рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Радиоактивность
Реферат Курсовая Конспект
Радиоактивность
Радиоактивность - раздел Химия, Химическая связь и строение вещества ...
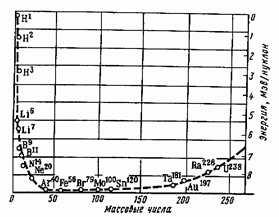
Рис. 1. Зависимость энергии связи нуклонов в ядре от А; кривая сглажена, выпадающие точки (4He, 16O, 28Si и др. не приведены) |
Ядро – не просто совокупность нуклонов, оно обладает определенным строением, рассмотрение которого выходит за рамки нашего курса и пособия. Выделим только важные для геологии следствия.
Свойства ядер зависят от количества образующих их протонов и нейтронов и их соотношения. Энергия связи ядер (на один нуклон) с ростом массового числа сначала растет, а потом падает; наиболее прочные ядра – для А от 40 до ~120, примерно от 40Ar до 119Sn, среди которых самое прочное ядро – 56Fe (рис. 1). Здесь и далее выделяющаяся энергия отрицательна, затраченная – положительна.
На фоне этой общей закономерности выделяются ядра, в которых число протонов Z или число нейтронов А – Z равно одному из так называемых магических чисел – 2, 8, 14, 20, 28, 50, 82 (плюс 40, 126, 152 – только для нейтронов). Это магические ядра. Наиболее устойчивы и распространены в природе ядра (и соответствующие химические элементы), в которых и число протонов, и число нейтронов – магические. Это дважды магические ядра: 4He, 16O, 28Si, 40Ca, 56Fe, 208Pb. Существует гипотеза о том, что в земной коре могут находиться сверхтяжелые дважды магические элементы с Z = 114 или 126 и числом нейтронов 184.
Большинство природных изотопов стабильны. У всех элементов от 1H до 83Bi (кроме 43Tc и 61Pm) имеются устойчивые изотопы, атомы которых сохраняют свои ядра (т. е. неизменный набор протонов и нейтронов) в течение многих миллиардов лет. Так что не будет преувеличением предположение о том, что такие атомы – ровесники как минимум возникновения нашей планеты, а может быть, и еще более древние... Согласитесь, любопытно было бы узнать, где были, в составе какого вещества (или одиноко летели по черным просторам Вселенной?), атомы углерода или азота Вашего организма несколько миллиардов лет назад…
Устойчивость ядер изотопов зависит от соотношения количества нейтронов и протонов. Для легких элементов обычно самые устойчивые и распространенные изотопы с Z = N = A – Z: 4He, 12C, 14N, 16O, 20Ne. С увеличением Z более устойчивы изотопы со все бóльшим относительным количеством нейтронов (превышающим количество протонов в 1,5 – 1,6 раза для Z ³ 90). Все природные и искусственные изотопы с Z > 83 (начиная с Po) – неустойчивы.
Это явление превращений неустойчивых ядер в другие, более устойчивые, с выделением легких частиц (электронов, позитронов или ядер 4He, называемых a-частицами), а также электромагнитного излучения, называется радиоактивным распадом (от лат. radio – излучаю, radius – луч, actions –активность). При радиоактивном распаде происходит самопроизвольное, т. е. без каких-либо внешних воздействий, превращение ядра в другое/другие ядро/ядра вследствие ядерных взаимодействий; изменение электронных оболочек при этом носит сопутствующий характер.
В зависимости от того, какие легкие частицы испускаются при радиоактивном распаде, выделяют различные типы радиоактивного распада: a-, b- или b+-распад (иногда выделяют как отдельный тип электронный захват) (табл. 2). Испускаемые при радиоактивном распаде высокоэнергетические электроны называют b‑частицами, позитроны – b+‑частицами, а фотоны (кванты электромагнитного излучения в коротковолновой, высокоэнергетической части спектра, с l ≤ 10-11 м) – g‑частицами.
Кроме выделения a- и b‑частиц, радиоактивный распад часто сопровождается высвечиванием коротковолнового электромагнитного излучения – g‑частиц, а также нейтрино (элементарная частица, не имеющая массы покоя и заряда).
Таблица 2
– Конец работы –
Эта тема принадлежит разделу:
Химическая связь и строение вещества
На сайте allrefs.net читайте: "Химическая связь и строение вещества"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Радиоактивность
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов