рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Размещение элементов по подгруппам в ПС
Реферат Курсовая Конспект
Размещение элементов по подгруппам в ПС
Размещение элементов по подгруппам в ПС - раздел Химия, Химическая связь и строение вещества Группа Подгруппа Валентные Электроны...
| Группа | Подгруппа | Валентные электроны | Элементы | Семейства |
| IA | ns1 | (1H), 3Li – 87Fr | s | |
| IIA | ns2 | 4Be – 88Ra | ||
| IIIB | (n-1)d1ns2 | 21Sc – 89Ac | d | |
| IVB | (n-1)d2ns2 | 22Ti – 104Db | ||
| VB | (n-1)d3ns2 | 23V – 105Jl | ||
| VIB | (n-1)d4ns2 | 24Cr – 106Rf | ||
| VIIB | (n-1)d5ns2 | 25Mn – 107Bh | ||
| VIIIB (элементы триад) | (n-1)d6ns2 | 26Fe – 108Hn | ||
| (n-1)d7ns2 | 27Co – 109Mt | |||
| (n-1)d8ns2 | 28Ni – 110Э | |||
| IB | (n-1)d10ns1 | 29Cu – 79Au | ||
| IIB | (n-1)d10ns2 | 30Zn – 80Hg | ||
| IIIA | ns2np1 | 5B – 81Tl | p | |
| IVA | ns2np2 | 6C – 82Pb | ||
| VA | ns2np3 | 7N – 83Bi | ||
| VIA | ns2np4 | 8O – 84Po | ||
| VIIA | ns2np5 | (1H), 9F – 85At | ||
| VIIIA | ns2np6 | 2He – 86Rn |
Встречаются и другие исключения из правил заполнения электронных конфигураций. Их в ПС около десятка. Самое важное – металлы подгруппы IB (Cu, Ag, Au), у которых фактически имеются электронные конфигурации (n ‑ 1)d10ns1, а не «теоретические» (n ‑ 1)d9ns2. Исключения связаны с тем, что энергии (n – 2)f, (n – 1)d и ns-электронов мало отличаются, а заполненные и полузаполненные подуровни (d10, f14, d5, f7) имеют повышенную устойчивость[§].
В длинной (развернутой) форме ПС 18 столбцов по количеству международных групп и 7 строк по количеству периодов, в сверхдлинной – 32 столбца, ns2(n–2)f14(n–1)d10np6 – по максимальному количеству внешних электронов.
В короткой форме ПС объединяют в один столбец элементы главной и соответствующей побочной подгрупп, причем элементы триад (групп 8–10 или подгруппы VIIIВ) помещают в один восьмой столбец, и столбцов получается восемь. Но начиная с 4-го периода в каждом из первых семи столбцов оказывается по два элемента главной и побочной подгрупп. Поэтому периоды с 4-го по 6-й делят на два ряда каждый – непереходных и переходных элементов; строчки также делят на две, и всего их получается 10: первые три соответствуют первым трем периодам; строки 4–5, 6–7, 8–9 – периодам 4-му, 5-му, 6-му; десятая строка – 7-му периоду, пока неполному. При этом приходится каждый ряд размещать в двух строках. Например, в первом ряду d-элементов, элементы от 21Sc до 28Ni оказываются в 4‑й строке, а 29Cu и 30Zn в пятой. Непереходные элементы периодов «разрываются» десяткой d-элементов и тоже попадают в разные строки: s-элементы (19K, 20Ca) – в четвертую, p-элементы (от 31Ga до 36Kr) – в пятую.
Семейства лантаноидов и актиноидов обычно помещают отдельно, вне таблицы ПС. Сверхдлинная форма включает семейства f-элементов в саму таблицу, которая насчитывает тогда 2 + 6 + 10 + 14 = 32 столбца и 7 строк по числу периодов, но такая форма неудобна для типографского воспроизведения. У каждой формы ПС есть свои достоинства и недостатки, но сверхдлинная форма точнее отражает электронное строение атомов.
От положения элемента в ПС полностью зависят его физико-химические свойства, причем изменяются они с ростом Z периодически. Например, размер атома.
Как уже говорилось, это условное понятие. Для иллюстрации периодичности свойств удобнее всего орбитальные радиусы атомов, Rорб., – расстояния от ядра до наиболее удаленного от него максимума электронной плотности. Для Н Rорб. равен боровскому радиусу, ~ 0,5 Å. Для Не возрастают заряд ядра и соответственно притяжение электронов к ядру, что должно уменьшать Rорб.. Но в противоположную сторону действует межэлектронное отталкивание (экранирование), которое должно уменьшать притяжение электронов к ядру и увеличивать их среднее расстояние от ядра. Более сильным оказывается первый эффект (в п. 2.2.2 приводилась оценка Z*Не » 1,7). Таким образом, Rорб.(Не) < Rорб.(Н). При переходе к Li более существенным оказывается увеличение числа электронных слоев с 1 до 2 – электроны с n = 2 оказываются более удаленными от ядра, чем для n = 1 не только для атомов Н (см. рис. 4), но и для многоэлектронных частиц.
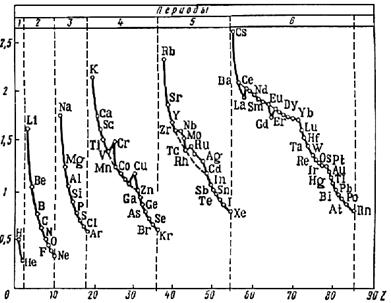 Рис. 12. Орбитальные радиусы атомов (в Å)
Рис. 12. Орбитальные радиусы атомов (в Å)
|
Зависимость Rорб. от Z приведена на рис. 12. Здесь важно усвоить две тенденции. Внутри периода орбитальные радиусы уменьшаются слева направо,вследствие того что в пределах одного электронного слоя увеличение заряда ядра преобладает над межэлектронным отталкиванием. По подгруппе Rорб. увеличиваются сверху вниз,вследствие того что увеличение числа электронных слоев доминирует над увеличением Z. От этих тенденций имеются незначительные отклонения, связанные главным образом с большей устойчивостью полузаполненных оболочек, о чем уже упоминалось ранее. Хотя данные рис. 12 – расчетные и далеко не для всех атомов можно экспериментально проверить эти расчеты, в целом указанные тенденции не вызывают никаких сомнений и подтверждаются реальными измерениями атомных и ионных радиусов (о чем пойдет речь в разд. 5) и крайне важны для понимания строения многих веществ и их химических свойств.
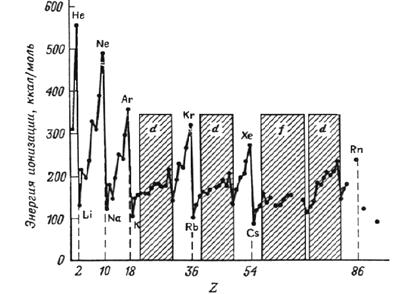
Интересно, что зависимость экспериментально измеренных энергий ионизации от Z имеет противоположный характер по сравнению с Rорб.(Z) (рис. 13). Это понятно, так как причины этой периодической зависимости те же – чем дальше находится валентный электрон от ядра и чем меньше эффективный заряд ядра, тем меньшая энергия тратится на его отрыв от атома. Поэтому наименьшая энергия ионизации в периоде всегда у элементов подгруппы IА (щелочных металлов), наибольшая – для VIIIА (благородных газов). По подгруппе потенциалы ионизации уменьшаются сверху вниз, от Li к Fr, О к Ро, F к Аt, и т. п.
Зависимость сродства к электрону Ее от Z сложнее, но можно выделить главное. Энергетически выгодно присоединение электрона к таким атомам, для которых при этом будет завершаться электронный слой (или стремиться к завершению, а также будет образовываться полузаполненный подуровень). Прежде всего, это атомы галогенов (группа VIIА), для которых Ее составляет приблизительно ‑3 эВ (минимальная величина для Cl и F около –3,5 эВ); сродство к электрону отрицательно (т. е. его присоединение энергетически выгодно) также для Н, О, Р и многих других атомов.
Отметим, что изотопы любого элемента, естественно, имеют одинаковую электронную конфигурацию и определяемые ей свойства, включая химические (от размера атомов, потенциала ионизации и расположения энергетических уровней до стехиометрии соединений). Различия проявляются только в свойствах, связанных с массой атомов, например в скоростях протекания реакций – изотопный эффект (наиболее существен для изотопов водорода, у которых массы отличаются в 2–3 раза, и незначителен для других элементов), и в магнитных свойствах, связанных со спином атомных ядер.
Рис. 13. Потенциалы ионизации атомов
 |
В природе не обнаружено до настоящего времени элементов с Z > 92 (трансурановых), а также практически не встречаются технеций 43Tc, прометий 61Pm, астат 85At и 87Fr франций. Эти элементы получены искусственным путем, с помощью ядерных реакций. Однако их электронное строение и физико-химические свойства полностью соответствуют изложенным закономерностям ПС.
Ядра некоторых природных изотопов и всех искусственно полученных неустойчивы, эти изотопы радиоактивны (разд. 1). При Z > 92 становятся неустойчивыми все ядра, причем чем больше Z, тем неустойчивее. Современные физические методы исследования позволяют регистрировать буквально единичные ядра таких элементов, полученных в ускорителях при условиях, далеких от нормальных; времена жизни таких частиц составляют от минут до долей секунды. Новые элементы синтезируют иногда по несколько изотопов в год, поэтому трудно точно сказать, на котором элементе обрывается сегодня ПС. Вряд ли пока можно говорить о химии этих элементов из-за очень малого, буквально в штуках атомов, их количества, короткого времени жизни и как следствие неизученности свойств.
Будут ли 121Э–138Э g-элементами? Ответа на этот вопрос пока нет. Скорее всего он риторический, так как пока что с ростом Z я́дра оказываются все менее стабильными. Впрочем, не опровергнута гипотеза о существовании «острова» стабильности для дважды магических ядер с Z = 114 или 126 (см. разд. 1).
Очень интересно, сколько новых элементов еще может быть получено? Современные теоретические расчеты показывают, что ПС должна закончиться примерно при Z = 150–168. При дальнейшем росте Z резко возрастает размер ядра и теоретики предсказывают электронный захват К- и L-электронов ядром, вместо синтеза новых элементов будут образовываться изотопы известных.
Пока синтез новых элементов и изотопов не выявил отклонений от изложенных закономерностей электронного строения атомов. Так что можно смело размещать 110Э в подгруппу VIIIB, 111Э в IB и т. п.
Вопросы для самопроверки
1. Запишите электронную конфигурацию элемента группы 14 (подгруппы VIIB) 4-го периода в основном состоянии.
2. Сколько элементов и почему содержится в каждом периоде?
3. У элементов каких подгрупп суммарный спин атома в основном состоянии равен 4?
4. Почему электронная конфигурация Cr отлична от предсказанной?
5. Что можно определить, зная атомный номер элемента?
6. Какая информация заложена в номере периода, группы, подгруппы?
7. Предскажите электронную конфигурацию 112Э.
8. Расположите в порядке возрастания радиусы F, F+ и F–.
9. Расположите в порядке возрастания радиусы Cl–, Ar, K.
10. Какие потенциалы ионизации больше – О или S; О или N?
11. Перечислите достоинства и недостатки (с Вашей точки зрения) разных форм записи периодической системы
.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА (длинная форма)
| Периоды | Группы элементов | |||||||||||||||||
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |||
| (1H) | 1H | 2He | ||||||||||||||||
| 3Li | 4Be | 5B | 6C | 7N | 8O | 9F | 10Ne | |||||||||||
| 11Na | 12Mg | 13Al | 14Si | 15P | 16S | 17Cl | 18Ar | |||||||||||
| 19K | 20Ca | 21Sc | 22Ti | 23V | 24Cr | 25Mn | 26Fe | 27Co | 28Ni | 29Cu | 30Zn | 31Ga | 32Ge | 33As | 34Se | 35Br | 36Kr | |
| 37Rb | 38Sr | 39Y | 40Zr | 41Nb | 42Mo | 43Tc | 44Ru | 45Rh | 46Pd | 47Ag | 48Cd | 49In | 50Sn | 51Sb | 52Te | 53I | 54Xe | |
| 55Cs | 56Ba | 57La* | 72Hf | 73Ta | 74W | 75Re | 76Os | 77Ir | 78Pt | 79Au | 80Hg | 81Tl | 82Pb | 83Bi | 84Po | 85At | 86Rn | |
| 87Fr | 88Ra | 89Ac** | 104Db | 105Jl | 106Rf | 107Bh | 108Hn | 109Mt | 110 | 111 | 112 | … | … | |||||
| s1 | s2 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | |
| s | d | p |
– Конец работы –
Эта тема принадлежит разделу:
Химическая связь и строение вещества
На сайте allrefs.net читайте: "Химическая связь и строение вещества"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Размещение элементов по подгруппам в ПС
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов