рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Многоэлектронные частицы
Реферат Курсовая Конспект
Многоэлектронные частицы
Многоэлектронные частицы - раздел Химия, Химическая связь и строение вещества В Многоэлектронных Частицах Каждый Из Электронов Притягивает...
В многоэлектронных частицах каждый из электронов притягивается к ядру и отталкивается от других электронов. Математическое описание поведения электронов в многоэлектронных частицах резко усложняется, и решить эти уравнения даже для двухэлектронных частиц (He, Li+ и других), не говоря о более сложных, удается лишь приближённо. И, как часто бывает, физики перенесли простую модель (одноэлектронное описание) на более сложные (многоэлектронные) системы, к которым, вообще говоря, оно неприменимо. Но, поскольку одноэлектронное приближение – атомные орбитали, задаваемые четверкой (n, ℓ, m, s), – очень простое и красивое, его распространяют и на многоэлектронные частицы. Однако за эти упрощения приходится расплачиваться.
Первым следствием является то, что взаимное отталкивание уменьшает энергию, необходимую для удаления электрона из атома. Это понятно из такого качественного примера. В некоторый момент времени на одной прямой могут оказаться ядро и два электрона, причём один из электронов окажется между ядром и вторым электроном. Понятно, что взаимное отталкивание облегчает удаление второго электрона. На самом деле на такую же величину уменьшается и энергия удаления первого электрона, причём при их любом взаимном расположении.
Явление взаимного ослабления притяжения электронов к ядруназывают экранированием: хотя реальный заряд ядра равен Z, но электроны в многоэлектронных частицах притягиваются к ядру так, как будто его «эффективный» заряд Z* < Z. Для рассмотренного примера ядра и электронов на одной линии можно говорить о внутреннем экранировании первым электроном второго и внешнем экранировании вторым – первого. Поэтому электрон в одноэлектронном ионе He+ сильнее притягивается к ядру, чем электроны в атоме He, и на энергетической диаграмме выше располагаются энергетические уровни He (см. рис. 9). К сожалению, не существует простых способов расчета Z* и вообще применимого для многоэлектронных частиц уравнения типа (5).
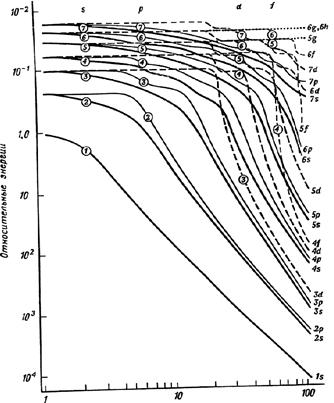
Рис. 10. Зависимость энергии АО многоэлектронных атомов от Z (масштаб логарифмический, кривые сглажены) |
Понижение энергии для одноэлектронных частиц ~Z2, а для многоэлектронных происходит при увеличении Z с разной «скоростью» для различных уровней Еn, ℓ (рис. 10).
Например, энергия и 2s-, и 2p-электронов в атоме Не выше по сравнению с уровнем Е2, вычисленным без учёта экранирования по уравнению (5). Но так как 2p-электроны в среднем располагаются дальше от ядра, чем 2s-электроны, то для них экранирование больше и 2р-уровень поднимается на диаграмме выше относительно энергии Е2, чем уровень 2s. Поэтому не только в атоме гелия, но и в любых других многоэлектронных частицах E2p > E2s > E2, E3d > E3p > E3s > E3, где Е2, Е3 – энергии, рассчитанные по уравнению (5). Поскольку с увеличением n расстояние между соседними одноэлектронными уровнями уменьшается, различная величина эффекта экранирования для АО с разными n и ℓ приводит к тому, что энергетические уровни многоэлектронных (т. е. реальных) частиц начиная с 3d «наезжают» друг на друга (см. рис. 10). Примерно с Z > 6 3d-уровень оказывается выше, чем 4s-уровень; с Z > 10 4d оказывается выше, чем 5s и т. д.
При больши́х Z уровни с одинаковым Z перегруппировываются и порядок их чередования определяется в первую очередь значением n (En+1, ℓ > En, ℓ), а внутри этих слоев энергия растет с увеличением ℓ (En, ℓ+1 > En, ℓ). В самой важной для химии промежуточной области 10 < Z < 100, где и располагается большинство элементов периодической системы, уровни пересекаются и располагаются в нерегулярной последовательности. Это, третье по нашей нумерации следствие влияния взаимного отталкивания электронов в атоме на положение энергетических уровней, пожалуй, самое неудобное для восприятия расположения энергетических уровней в многоэлектронных частицах. Опять-таки не существует простых способов вычисления, на какую величину отличаются энергетические уровни E2s и E2p; E3s, E3p, и E3d, и вообще простого уравнения для энергии многоэлектронных частиц En, ℓ, подобного уравнению (5), хотя такая зависимость очень важна для химии.
В итоге, как установлено экспериментально, энергия АО для нейтральных атомов в основном состояниивозрастает в следующей последовательности (рис. 11):
1s-2s-2p-3s-3p-4s-3d-4p-5s-4d-5p-6s-4f-5d-6p-7s-5f-6d-7p,
которую нужно просто запомнить. Запоминанию помогает эмпирическое правило правило n + ℓ: энергия АО нейтральных атомов в основном состоянии возрастает в порядке увеличения суммы n + ℓ, а при одном и том же значении этой суммы ниже располагаются уровни с меньшим n. Отметим близость энергий следующих АО: E3d » E4s, E4d » E5s, E4f » E5d » E6s, E5f » E6d »E7s.
| Е Е | 7p | ¾ | ¾ | ¾ | ||||||||
| 6d | ¾ | ¾ | ¾ | ¾ | ¾ | ||||||||
| 5f | ¾ | ¾ | ¾ | ¾ | ¾ | ¾ | ¾ | ||||||
| 7s | ¾ | ||||||||||||
| 6p | ¾ | ¾ | ¾ | ||||||||||
| 5d | ¾ | ¾ | ¾ | ¾ | ¾ | ||||||||
| 4f | ¾ | ¾ | ¾ | ¾ | ¾ | ¾ | ¾ | ||||||
| 6s | ¾ | ||||||||||||
| 5p | ¾ | ¾ | ¾ | ||||||||||
| 4d | ¾ | ¾ | ¾ | ¾ | ¾ | ||||||||
| 5s | ¾ | ||||||||||||
| 4p | ¾ | ¾ | ¾ | ||||||||||
| 3d | ¾ | ¾ | ¾ | ¾ | ¾ | ||||||||
| 4s | ¾ | ||||||||||||
| 3p | ¾ | ¾ | ¾ | ||||||||||
| 3s | ¾ | ||||||||||||
| 2p | ¾ | ¾ | ¾ | ||||||||||
| 2s | ¾ | ||||||||||||
| 1s | ¾ |
| Рис. 11. Энергетические уровни многоэлектронных атомов (масштаб примерно соблюден) |
Ещё более запутывает ситуацию то, что эффект экранирования зависит от количества электронов и их расположения по АО для одного и того же атома. В результате этого, как будет показано ниже, расположение энергетических уровней для нейтральных атомов и их ионов в некоторых случаях отличается и может отличаться даже расположение уровней для одной и той же частицы в основном и возбуждённых состояниях.
Кроме того, как можно заметить на рис. 10, с изменением Z нейтральных атомов наблюдается пересечение уровней: 3d и 4s ; 4d и 5s и т. д.
И всё же отмеченные недостатки не перечёркивают достоинств переноса одноэлектронного описания на многоэлектронные системы: простота, полное совпадение электронных конфигураций с экспериментально установленными, позволившее обосновать Периодическую систему Д. И. Менделеева (1869) – ради этого можно запомнить правило n + ℓ. Возможно, в будущем найдут более адекватное описание многоэлектронных систем – на основе не четырёх квантовых чисел, а пяти (такие серьёзные попытки уже есть) или иное.
Вернемся к важнейшей для химии характеристике электрона – его энергии. Уточним термины: в химии энергия атома – это почти всегда энергия его электронов. Энергия движения атома как целого (тепловая) по величине гораздо меньше электронной, а энергия атомного ядра гораздо больше, но ядра остаются неизменными при химических реакциях. Химические превращения – это процессы с участием электронов.
Для того чтобы «оторвать» от нейтрального атома электрон, требуется затратить энергию. Энергия процесса
– Конец работы –
Эта тема принадлежит разделу:
Химическая связь и строение вещества
На сайте allrefs.net читайте: "Химическая связь и строение вещества"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Многоэлектронные частицы
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов