рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Жидкость
Реферат Курсовая Конспект
Жидкость
Жидкость - раздел Химия, ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ При Дальнейшем Понижении Т (Повышении Р) Вещества Переходят В Конденсированно...
При дальнейшем понижении Т (повышении р) вещества переходят в конденсированное (чаще жидкое) состояние[†††]. Конденсация (кристаллизация) – резкое изменение всех свойств вещества: плотности, энергии, подвижности частиц и др. Между газом, жидкостью и твёрдым состоянием нет плавных переходных состояний, превращения веществ из одних агрегатных состояний в другие (фазовые переходы, ФП) происходят скачкообразно**!
Причины конденсации – ковалентные и нековалентные взаимодействия, рассмотренные в пп. 4.1–4.5. Энергия этих взаимодействий в конденсированном состоянии как минимум сравнивается с тепловой энергией частиц (молекул, атомов, ионов), а чаще превосходит её. Последствия этого важны и многочисленны: увеличение плотности на порядки, до ~1¸10 г/см3[‡‡‡]; трудность взаимного перемещения частиц – для этого требуются затраты энергии, так называемый активационный механизм диффузии; сохранение объёма; появление границ раздела (поверхностей, отделяющих конденсированные вещества от внешней среды); практическая несжимаемость и др.
Жидкости сохраняют объём, но не форму – они, как и газ, принимают форму сосуда**. Более строго это означает, что в жидкостях отсутствует сопротивление деформации – даже при действии на поверхность жидкости бесконечно малой силы, направленной параллельно поверхности, жидкость претерпевает конечную, причём необратимую сдвиговую деформацию (её модуль сдвига равен 0).
В обычных, классических жидкостях взаимное расположение частиц частично упорядоченное: если описывать вокруг выделенной частицы сферы увеличивающегося радиуса r и откладывать по оси ординат количество других частиц, оказавшихся на этой сфере, то график при малых r будет представлять собой кривую с максимумами и минимумами, но чем больше r, тем более сглаженными будут эти максимумы – это пример ближнего порядка. Например, непосредственно вокруг частицы (в первой координационной сфере) может быть восемь соседних частиц, а во второй от 11 до 13 и т. п. В газе никакого упорядоченного размещения частиц в пространстве нет в принципе; в кристаллах, наоборот, периодичность размещения частиц идеальна, даже при r ® ¥ – дальний порядок.
Если аккуратно налить в один сосуд две смешивающиеся жидкости и сохранять условия, при которых не образуется конвекционных потоков, перемешивание может происходить разное время в зависимости от их вязкости, но в любом случае существенно дольше, чем для газов.
Свойства классических жидкостей не зависят от направления – они изотропны (как и газы). Но существуют анизотропные жидкости с дальним порядком – жидкие кристаллы (другое название – мезофазы). Они образуются в тех случаях, когда молекулы имеют вытянутую форму и «упаковываются» в жидком состоянии параллельно друг другу. Дальний порядок в них может соблюдаться только в одном или в двух направлениях.
Свойства жидкостей существенно зависят от температуры. Вблизи температур плавления некоторые их свойства (прежде всего подвижность частиц и вязкость) близки к свойствам твёрдых веществ, а вблизи температур кипения приближаются к газам.
4.6.3. Твёрдое состояние
Твёрдые тела отличаются от газов и жидкостей прежде всего сопротивлением к деформации – как направленным параллельно (сдвиговым), так и перпендикулярно их поверхности (сжимающим или растягивающим), их упругие модули не равны 0. Иначе – твёрдые тела сохраняют форму. До определённого предела (предела упругости) деформация обратима, после него становится необратимой (пластической), далее происходит разрушение твердого тела на меньшие фрагменты. Эти механические свойства твёрдых тел не связаны непосредственно с их кристалличностью, а в первую очередь определяются типом химической связи (что уже рассмотрено в пп. 4.1–4.5).
Твёрдые вещества могут быть (в принципе) кристаллическими и некристаллическими (аморфными). Некристаллические часто можно рассматривать как замороженные жидкости, отличающиеся от них только сопротивлением сдвигу и меньшей подвижностью[§§§]. Как правило, подвижность частиц в твёрдых телах (почти независимо от их кристалличности) на порядки меньше подвижности в жидкостях.
Кристаллы с сохраняющимся до r ® ¥ дальним порядком называют идеальными. Взаимные перемещения частиц в них вследствие полного заполнения частицами всех узлов решётки, возможно только путём обмена местами, что требует больших затрат энергии, так как частицам нужно «протискиваться» между соседними («пустое» пространство в кристаллах обычно минимально); такое перемещение можно сравнить с обменом местами пассажирами в переполненном автобусе. Поэтому, как правило, реально диффузия в кристаллах происходит с участием вакантных узлов – дефектов решётки, см. далее в подразд. 4.7. Особенности движения частиц для различных агрегатных состояний схематически показаны на рис. 39.

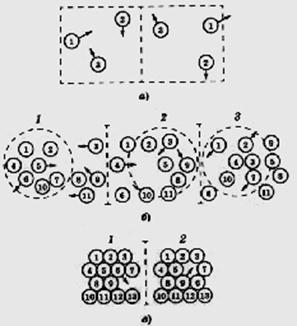 Кристаллы – анизотропны, некристаллические вещества обычно изотропны. Существуют природные некристаллические вещества и получаемые искусственно (путём быстрого охлаждения расплавов, механическими воздействиями, химическими реакциями и др.). Известный пример аморфного вещества – оконное стекло, представляющее по составу силикатную систему. Кварц может существовать как в кристаллическом, так и в аморфном (стеклообразном) состоянии. В последнем сохраняются кремнекислородные тетраэдры (ближний порядок), но далее периодичность их размещения постепенно нарушается при увеличении r (отсутствие дальнего порядка). Стёкла – разновидность некристаллических веществ, получаемых при быстром охлаждении расплавов; они имеют более высокую энергию по сравнению с кристаллическим состоянием, при нагревании снова превращаются в жидкость.
Кристаллы – анизотропны, некристаллические вещества обычно изотропны. Существуют природные некристаллические вещества и получаемые искусственно (путём быстрого охлаждения расплавов, механическими воздействиями, химическими реакциями и др.). Известный пример аморфного вещества – оконное стекло, представляющее по составу силикатную систему. Кварц может существовать как в кристаллическом, так и в аморфном (стеклообразном) состоянии. В последнем сохраняются кремнекислородные тетраэдры (ближний порядок), но далее периодичность их размещения постепенно нарушается при увеличении r (отсутствие дальнего порядка). Стёкла – разновидность некристаллических веществ, получаемых при быстром охлаждении расплавов; они имеют более высокую энергию по сравнению с кристаллическим состоянием, при нагревании снова превращаются в жидкость.
Получены аморфные полупроводники (кремний), так что зонная структура разрешённых значений энергии тоже не связана напрямую с кристалличностью. Это всё примеры ковалентных некристаллических веществ. Труднее получить аморфные металлы, но получены и они (для простых металлов некристаллическое состояние устойчиво только при очень низких температурах, для сплавов и соединений – и при комнатной). Известны аморфные соединения с ионно-ковалентной связью (например, оксиды). Не получены аморфные чисто ионные соединения – нарушение регулярного чередования разноимённо заряженных ионов приводит к слишком большому увеличению энергии. Трудно представить и аморфные молекулярные соединения, так как, даже если их получить, они легко восстановят кристаллическое состояние вследствие малой (по сравнению с тепловой) энергией межмолекулярных взаимодействий.
Следует отличать некристаллические и поликристаллические вещества. Хотя в кристаллах имеется дальний порядок, они конечны. Реальные размеры кристаллов (они могут иметь названия микрокристаллов, кристаллитов, блоков, зёрен) различных природных веществ разные – от ~ 50 Å до 1 дм; они могут сосуществовать друг с другом, как зёрна в металлах, разделяясь межзёренными (межкристаллитными и т. п.) границами, или с кристаллами других веществ, тогда границы раздела называют межфазными. Кристаллическое вещество независимо от размеров кристаллов, характеризуется определённой температурой плавления[****]; только при этой температуре могут сосуществовать кристаллы и расплав. Некристаллические плавно изменяют свои свойства (плотность, вязкость и т. п.) при повышении температуры в достаточно широком интервале и не имеют точной температуры плавления.
Обобщение различий в физических свойствах веществ в разных агрегатных состояниях дано в табл. 15, с. 122.
– Конец работы –
Эта тема принадлежит разделу:
ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ
На сайте allrefs.net читайте: "ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Жидкость
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов