рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Представление о зонной теории
Реферат Курсовая Конспект
Представление о зонной теории
Представление о зонной теории - раздел Химия, ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ При Взаимодействии Двух Атомов С Неспаренными Электронами Образуются Две Моле...
При взаимодействии двух атомов с неспаренными электронами образуются две молекулярные орбитали (МО), одна из которых имеет более низкую энергию, чем исходные АО и является связывающей, а уровень второй лежит выше исходных. При взаимодействии трёх атомов образуется три МО, при взаимодействии N атомов – N МО для каждой АО (рис. 34). Подчеркнём, что для такого взаимодействия каждый из N атомов должен иметь соседей на близких (для образования связи) расстояниях, и вся совокупность атомов должна располагаться компактно, т. е. при N ~ NА речь идёт фактически о конденсированном состоянии.

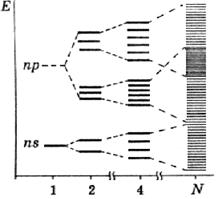 В результате каждый из исходных энергетических уровней расщепляется в достаточно широкую (~1 эВ) полосу (зону), которые разделены зонами запрещённых значений энергии примерно такой же ширины. Эти энергетические зоны называют соответственно разрешёнными и запрещёнными. Для больши́х N ~ NА энергетические уровни внутри разрешённых зон располагаются настолько близко друг от друга, что можно считать разрешёнными все значения энергии в зоне. Разрешённые зоны могут пересекаться, полностью перекрывая некоторые из запрещённых зон.
В результате каждый из исходных энергетических уровней расщепляется в достаточно широкую (~1 эВ) полосу (зону), которые разделены зонами запрещённых значений энергии примерно такой же ширины. Эти энергетические зоны называют соответственно разрешёнными и запрещёнными. Для больши́х N ~ NА энергетические уровни внутри разрешённых зон располагаются настолько близко друг от друга, что можно считать разрешёнными все значения энергии в зоне. Разрешённые зоны могут пересекаться, полностью перекрывая некоторые из запрещённых зон.
Заполнение уровней электронами происходит согласно уже описанным принципам – наименьшей энергии и Паули. На одном уровне (внутри разрешённых зон) может располагаться не более двух электронов с разными спинами. Поэтому, как и для дискретных уровней, энергетические зоны могут быть полностью заполненными (2N электронов на N уровнях в зоне), или полузаполненными (N электронов на N уровнях), или вакантными (свободными). Если нет пересечения зон, то верхняя из заполненных, называемая по аналогии валентной, будет полузаполненной при нечётном числе электронов на соответствующей АО и заполненной при чётном. Первая ситуация реализуется, например, для элементов подгруппы IА; вторая – для IVА. Пересечение зон наблюдается для элементов подгруппы IIА.
 В итоге возможны два принципиально отличающихся по возможности проводить электрический ток (и многим другим важным свойствам) случая: металлы и неметаллы (диэлектрики).
В итоге возможны два принципиально отличающихся по возможности проводить электрический ток (и многим другим важным свойствам) случая: металлы и неметаллы (диэлектрики).
абвг
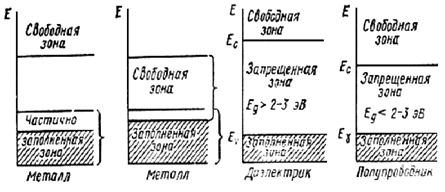
 Первый – когда верхняя из имеющих электроны энергетических зон оказывается частично заполненной (рис. 35) – либо при нечетном числе электронов без пересечения зон (а), либо в случае пересечения и при их чётном числе (б). В этом случае самый верхний из заполненных и самый нижний из вакантных уровней располагаются практически вплотную. Переход валентного электрона на вышележащий уровень требует бесконечно малой энергии (а энергия электрона в реальных полях на много порядков меньше тепловой энергии электронов и тем более энергий, разделяющих зоны). Поэтому в электрическом поле электроны могут свободно перемещаться в пространстве, используя вакантные уровни, т. е. во внешнем поле возникает поток заряженных электронов – электрический ток. Энергетическую зону, в которой возможно перемещение электронов в поле, называют зоной проводимости. В рассматриваемом случае (рис. 35, а и б) нет запрещённой зоны между верхним из заполненных и нижним вакантным уровнями, т. е. между валентной зоной и зоной проводимости. Такие вещества, в которых валентная зона и зона проводимости совпадают (иначе – ширина запрещённой зоны равна 0), называют проводниками или металлами.
Первый – когда верхняя из имеющих электроны энергетических зон оказывается частично заполненной (рис. 35) – либо при нечетном числе электронов без пересечения зон (а), либо в случае пересечения и при их чётном числе (б). В этом случае самый верхний из заполненных и самый нижний из вакантных уровней располагаются практически вплотную. Переход валентного электрона на вышележащий уровень требует бесконечно малой энергии (а энергия электрона в реальных полях на много порядков меньше тепловой энергии электронов и тем более энергий, разделяющих зоны). Поэтому в электрическом поле электроны могут свободно перемещаться в пространстве, используя вакантные уровни, т. е. во внешнем поле возникает поток заряженных электронов – электрический ток. Энергетическую зону, в которой возможно перемещение электронов в поле, называют зоной проводимости. В рассматриваемом случае (рис. 35, а и б) нет запрещённой зоны между верхним из заполненных и нижним вакантным уровнями, т. е. между валентной зоной и зоной проводимости. Такие вещества, в которых валентная зона и зона проводимости совпадают (иначе – ширина запрещённой зоны равна 0), называют проводниками или металлами.
Вещества, у которых валентная зона оказывается полностью заполненной, относят к неметаллам (диэлектрикам или полупроводникам). В этом случае (рис. 35, в и г) валентная зона отделена от зоны проводимости запрещённой зоной некоторой конечной ширины. Принципиального различия между ситуациями при Т = 0 К нет, оно лишь количественное, в ширине запрещённой зоны (ЗЗ). Но при температурах порядка комнатной и выше различия в реальной электронной проводимости (способности проводить ток) между такими веществами настолько существенна, что первые с шириной ЗЗ более 2-3 эВ относят к диэлектрикам или изоляторам (рис. 35, в), а вторые с меньшей шириной ЗЗ – к другому классу неметаллов – полупроводникам (рис. 35, г).
Тепловая энергия электронов пропорциональна кТ, где к – постоянная Больцмана. При Т > 0 К отдельные электроны могут иметь достаточно высокую энергию и «перескакивать» из валентной зоны в зону проводимости. Фактически это процесс возбуждения электронов из основного состояния, совершенно аналогичный электронному возбуждению в атомах или молекулах. Он может происходить под действием как температуры, так и света. При этом становится возможным и движение возбуждённых в зону проводимости электронов (их так и называют – электроны проводимости), и движение оставшихся в валентной зоне электронов по образовавшимся вакантным уровням.
Доля электронов проводимости N/N0 ~exp(-DE/kT) при Т, не превышающих температуры плавления, очень мала и не превышает 10-10 при реальных DE @ 1 эВ (здесь N – количество электронов проводимости; N0 – общее количество валентных электронов; DE – ширина запрещённой зоны; k – постоянная Больцмана; T – температура). Поэтому удобнее рассматривать не движение большого количества электронов в валентной зоне, N ~ NА, а движение образованных ими вакансий, называемых дырками, имеющими формально положительный заряд (рис. 36). Количества электронов проводимости и дырок в валентной зоне равны, дырки движутся по полю, электроны – против поля. Такие вещества называются собственными (компенсированными)полупроводниками. При большой ширине запрещённой зоны (более 2–3 эВ) носителей заряда (электронов проводимости и дырок) так мало, что их нельзя зафиксировать не только при комнатной, но и при более высоких температурах, вплоть до плавления, и реально такие вещества не проводят ток – это диэлектрики. При меньшей DE проводимость можно обнаружить до температур 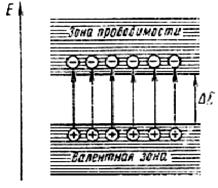 плавления, такие вещества относят к полупроводникам.
плавления, такие вещества относят к полупроводникам.
 Собственный полупроводник – это возбуждённый диэлектрик. При Т = 0 К в основном состоянии, он не проводит, при Т > 0 К величина проводимости на много порядков уступает проводимости металлов (в металлах в проводимости участвуют все валентные электроны независимо от Т, в полупроводниках количество участвующих в проводимости частиц экспоненциально растёт с Т). Реально представляют интерес и находят широкое применение не собственные, а другие, примесные полупроводники.
Собственный полупроводник – это возбуждённый диэлектрик. При Т = 0 К в основном состоянии, он не проводит, при Т > 0 К величина проводимости на много порядков уступает проводимости металлов (в металлах в проводимости участвуют все валентные электроны независимо от Т, в полупроводниках количество участвующих в проводимости частиц экспоненциально растёт с Т). Реально представляют интерес и находят широкое применение не собственные, а другие, примесные полупроводники.
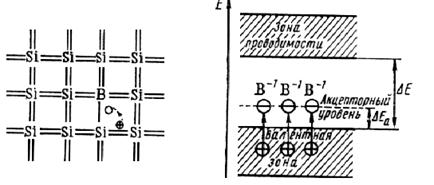
При наличии в полупроводнике небольших количеств иных атомов (примеси) в зависимости от заполнения его зон, числа электронов примеси и её природы возможно разное расположение локальных энергетических уровней атомов примеси – в разрешённых зонах или в запрещённой. Электроны примеси, располагающиеся на уровнях в зоне проводимости, присоединяются к электронам проводимости и незначительно увеличивают их общее количество. Не представляет особого интереса и расположение энергетических уровней примеси примерно в середине запрещённой зоны, хотя и влияющее на проводимость. Интересны и нашли широкое применение два предельных случая расположения энергетических уровней примеси – вверху или внизу запрещённой зоны при полностью 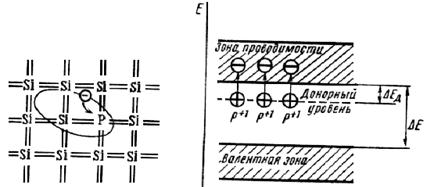 заполненной валентной и вакантной зоне проводимости (рис. 37 и 38 соответственно).
заполненной валентной и вакантной зоне проводимости (рис. 37 и 38 соответственно).
а б
 а б
а б
 В первом случае, например при наличии в кремнии (гр. IVА, ковалентность 4) фосфора (VА, 5 валентных электронов), возбуждение одного из электронов фосфора в зону проводимости, требующее энергии DЕД (см. рис. 37), происходит гораздо легче, чем собственных электронов Si из его валентной зоны, так как DЕД меньше ширины запрещённой зоны DЕ (обычно примерно на порядок). Уже при комнатной Т вся примесь может ионизоваться до Р+ и количество электронов проводимости становится примерно равным количеству атомов примеси. Причём в веществе имеются только отрицательно заряженные носители заряда. Такие полупроводники называются электронными, или n-типа (negative).
В первом случае, например при наличии в кремнии (гр. IVА, ковалентность 4) фосфора (VА, 5 валентных электронов), возбуждение одного из электронов фосфора в зону проводимости, требующее энергии DЕД (см. рис. 37), происходит гораздо легче, чем собственных электронов Si из его валентной зоны, так как DЕД меньше ширины запрещённой зоны DЕ (обычно примерно на порядок). Уже при комнатной Т вся примесь может ионизоваться до Р+ и количество электронов проводимости становится примерно равным количеству атомов примеси. Причём в веществе имеются только отрицательно заряженные носители заряда. Такие полупроводники называются электронными, или n-типа (negative).
Другая ситуация – уровни примеси внизу запрещённой зоны, рядом с потолком валентной – показана на рис. 38. Здесь примесь (например, трёхвалентный бор в кремнии) легко захватывает электроны из валентной зоны Si, ионизуясь до В-, при этом образуются положительные носители заряда в валентной зоне – дырки. Это полупроводники р-типа (positive), или дырочные.
Возможно присутствие в полупроводнике одновременно донорных и акцепторных примесей и смешанная проводимость (n и р).
Именно рассмотренные явления лежат в основе таких устройств, как диоды, транзисторы, фотоэлементы, интегральные схемы, служащие основой компьютерных процессоров, и т. п. Конечно, для соответствующих устройств используются не природные примеси, наоборот, соответствующий полупроводниковый материал (чаще всего Si или Gе) сначала тщательно очищают, а потом допируют (легируют), вводя в необходимых количествах нужные добавки в заданные места кристалла. При этом концентрации добавок могут быть очень малы – 10-5 % и менее, и должны точно выдерживаться по составу и количеству. Но для химии важнее, что одним из многих замечательных свойств полупроводников является то, что крайне малые количества примеси (10-5 % и менее) вызывают изменение количества электронов проводимости на много порядков. Небольшие изменения количества самих примесей могут вызывать неаддитивные изменения концентрации электронов проводимости и дырок. Эти явления проявляются в химических реакциях, существенно меняя их скорость и механизм. А полупроводники – вовсе не экзотика, к ним относятся не только Si и Ge, но и многие сульфиды. Оксиды металлов, как правило, диэлектрики. Но, как показано выше, между диэлектриками и полупроводниками нет резкой границы и рассмотренные явления имеют место и в оксидах, в том числе при протекании реакций окисления металлов или восстановления оксидов, имеющих важное значение, в том числе и для геологии.
В табл. 12 систематизирована классификация веществ по электронной проводимости. Если соотнести эту классификацию с классификацией твёрдых веществ по типам связи, то проводниками (металлами) оказываются такие простые вещества, которые легко отдают свои валентные электроны для обобществления, т. е. имеют малые потенциалы ионизации, а также их соединения и растворы (сплавы).
Таблица 12
– Конец работы –
Эта тема принадлежит разделу:
ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ
На сайте allrefs.net читайте: "ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Представление о зонной теории
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов