рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Водородная связь
Реферат Курсовая Конспект
Водородная связь
Водородная связь - раздел Химия, ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ Свойства Водородных Соединений Нf, Н2O, Nн3 Сильно Отли...
Свойства водородных соединений НF, Н2O, NН3 сильно отличаются от их аналогов НГ (Г – галоген), H2X (X – халькоген), ЭН3 (Э = P, As, Sb, Bi). Если предположить, что межмолекулярное взаимодействие в жидких H2X вандерваальсовое, то температуры кипения должны расти от Н2О к Н2Те, что и выполняется, но за исключением воды (табл. 11).
Таблица 11
Свойства соединений Н2Х
| Соединение | H2O | H2S | H2Se | H2Te |
| Температура плавления, ºС | -86 | -66 | -51 | |
| Температура кипения, ºС | -60 | -41 | -2 |
Существенно более высокие температуры плавления и кипения по сравнению с таковыми для аналогов свидетельствуют о наличии более прочных связей между молекулами в НF, Н2O, NН3, чем вандерваальсовые. Подобного явления нет в ряду соединений с водородом элементов группы IVА – температуры кипения и плавления монотонно увеличиваются от СН4 к SnН4, метан не выпадает из этой закономерности. Пришлось для таких взаимодействий выделить отдельную классификационную «полку». Дополнительное связывание между атомом водорода одной молекулы, соединённого ковалентной связью с электроотрицательным атомом Х, с небольшим электроотрицательным атомом Y другой молекулы (где Y – прежде всего F, O, N), называется водородной связью (рис. 33, а).
 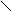 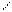  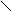   а
¾Х¾H1×××××××2Y¾
б
F¾H×××××××F
H а
¾Х¾H1×××××××2Y¾
б
F¾H×××××××F
H
| в H H O×××××××H¾F×××××××H¾O H | г H O×××××××H¾O H H |
Рис. 33. Примеры водородной межмолекулярной связи
На рис. 33 точечной линией показана водородная связь между двумя молекулами HF (б), между молекулами воды (г) и между тремя молекулами (в). Обычно водородную связь образуют такие атомы водорода, которые связаны в первой молекуле полярной связью с другим атомом X (F, O, N, Cl, S, C[§]). Партнёром атома Н по водородной связи бывают обычно F, O, N, в меньшей степени характерно образование H-связей для Cl, Br и S. Атом водорода попадает на линию, соединяющую атомы X и Y, но не на середину, хотя длина ковалентной связи X–H несколько увеличивается после образования водородом Н-связи, она остаётся более короткой и более прочной, чем образующаяся водородная связь H×××××××××Y, обозначаемая обычно точками или пунктиром**.
В метане связи неполярные, и атом С не образует водородной связи с атомами Н других молекул СН4.
Природа водородной связи промежуточная между ковалентной, ионной и диполь-дипольной. Можно рассматривать механизм её образования как сумму совместных вкладов различных типов связи. Частично это полярная ковалентная донорно-акцепторная связь, Н – частичный акцептор, Y – частичный донор электронной пары, можно рассматривать вклад от электростатического взаимодействия между Нd+ и Yd- – энергия из-за «частичности» оказывается меньше, чем энергия полноценных ковалентной или ионной связей. Можно трактовать Н-связь как предельный случай вандерваальсовой связи, более прочной, чем обычно, из-за малых размеров и, следовательно, большого поляризующего действия, имеющего частичный положительный заряд d+ атома водорода.
Энергия водородной связи тоже промежуточная между значениями, типичными для химических и вандерваальсовых связей, составляет 0,1–0,4 эВ и имеет наибольшие значения, если атом Y – фтор или кислород.
Важна не трактовка, а результат образования Н-связи. Так, вода оказывается жидкой в диапазоне температур вблизи обычных для Земли и живых организмов исключительно благодаря тому, что вода и лёд «перешиты» водородными связями (каждая молекула образует четыре водородные связи с соседними молекулами – по две за счёт каждого из атомов Н и ещё две за счёт неподелённых электронных пар атома О), чего нет в H2S и аналогах. Важность этого феномена для жизни на Земле можете обдумать сами: что было бы с водоёмами, да и с нами, если бы Н2О кипела примерно при –80 °С, получающихся при экстраполяции данных табл. 11 для H2S – H2Te – H2S на воду? Водородная связь имеется и играет важную роль в биологических кристаллах – белках, углеводах, ДНК.
Водородная связь может быть и внутримолекулярной, между фрагментами одной и той же молекулы, как правило, органической. В этом случае, оттягивая часть электронной плотности от межмолекулярных связей, она не упрочняет, а разупрочняет конденсированное состояние.
Исключительная роль принадлежит водородной связи в механизме передачи наследственности. Пуриновые и пиримидиновые основания в противоположных нитях двойной спирали ДНК – хранителе и носителе генетического кода – связаны между собой именно водородной связью. Почему?
Допустим, что комплиментарные пары были бы связаны ковалентно, прочными связями. Тогда информация (взаимное чередование нуклеотидов) была бы записана надёжно – разорвать прочные связи трудно. Но как её можно было бы передавать? Во-первых, чтобы разорвать ковалентные связи, нужна большая энергия, т. е. высокие температуры, высокоэнергетическое УФ-излучение или хотя бы видимый свет. Во-вторых, разрывались бы связи не только между комплиментарными нуклеотидами, между двумя нитями двойной спирали, но и такие же ковалентные связи внутри нитей – прочно и надёжно хранимую информацию стало бы невозможно передавать!
Если бы пары носителей информации были бы связаны слабыми вандерваальсовыми связями, лёгкость их разрыва обеспечила бы и лёгкость передачи информации. Но по той же причине информация будет легко искажаться – возникают проблемы с её хранением, сразу после передачи требуется «замораживание», а для акта передачи опять «размораживание».
И природа нашла оптимум в виде водородной связи, которую достаточно легко разорвать при условиях, характерных для живых организмов (36,6 °С для человека, например), но в то же время не настолько легко, чтобы этот процесс протекал постоянно, как фоновый, что было бы в случае вандерваальсовых связей между носителями генетического кода.
Вопросы для самопроверки
1. Перечислите все три типа диполь-дипольных взаимодействий.
2. Сравните энергии диполь-дипольных и ион-ионных взаимодействий с энергией ковалентных связей.
3. Сравните поляризуемость в рядах He-Ne-Ar-Kr-Rn; SO2-SeO2-TeO2; С2Н6- С2Н4-С2Н2.
4. Приведите свои примеры водородной связи.
5. Почему ковалентная связь насыщаемая, а ионная и вандерваальсовая нет?
6. Для каких типов связи имеется пространственная направленность?
7. Перечислите характерные свойства молекулярных кристаллов.
8. Для каких из перечисленных соединений возможно образование межмолекулярной водородной связи: NH3, PH3, C6H14, C6H13OH?
9. Какие примерно температуры плавления и кипения имела бы вода при отсутствии водородных связей и что было бы на Земле?
– Конец работы –
Эта тема принадлежит разделу:
ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ
На сайте allrefs.net читайте: "ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Водородная связь
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов