рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Ковалентные кристаллы
Реферат Курсовая Конспект
Ковалентные кристаллы
Ковалентные кристаллы - раздел Химия, ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ Взаимодействие Атомов Может Приводить К Образованию Молекул, Содержащих Не То...
Взаимодействие атомов может приводить к образованию молекул, содержащих не только 2, 3, 4, …, но ~104–105 и более атомов. Их называют макромолекулами или высокомолекулярными соединениями (например, белки, ферменты, ДНК; получены и неорганические макромолекулы). Если макромолекулы состоят из повторяющихся одинаковых или однотипных фрагментов (мономеров), их называют полимерами, простейшим примером которых является полиэтилен, (–СН2–)n, где n может достигать больших значений. Такие одномерные цепочки нежесткие и могут образовывать упорядоченные или неупорядоченные агрегаты (глобулы, клубки). Жесткость появляется при трехмерном строении полимеров. Правильное чередование атомов или молекулярных фрагментов в двух или трех направлениях приведет к образованию ковалентных (другое название – атомных) кристаллов. Это построенные из атомов углерода алмаз и из кремния и кислорода диоксид кремния SiО2 (прежде всего кварц).
 Структурными единицами в таких кристаллах являются атомы(поэтому они атомные), объединенные ковалентной связью (поэтому – ковалентные). И хотя в широком смысле любые вещества, включая кристаллические, состоят из атомов, только в атомно-ковалентных кристаллах они являются исходными структурными единицами.
Структурными единицами в таких кристаллах являются атомы(поэтому они атомные), объединенные ковалентной связью (поэтому – ковалентные). И хотя в широком смысле любые вещества, включая кристаллические, состоят из атомов, только в атомно-ковалентных кристаллах они являются исходными структурными единицами.
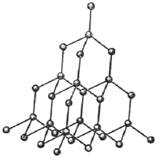
 Так, алмаз представляет собой гигантскую молекулу, которую можно увидеть невооружённым глазом (алмаз в 60 карат – это 1 моль углерода, 6·1023 атомов С). Каждый атом образует ковалентные связи с четырьмя такими же атомами, валентные углы – тетраэдрические, и это строго периодически повторяется во всём объёме кристалла, так что можно формально рассматривать алмаз как трёхмерный полимер, где мономер – атом С (рис. 28).
Так, алмаз представляет собой гигантскую молекулу, которую можно увидеть невооружённым глазом (алмаз в 60 карат – это 1 моль углерода, 6·1023 атомов С). Каждый атом образует ковалентные связи с четырьмя такими же атомами, валентные углы – тетраэдрические, и это строго периодически повторяется во всём объёме кристалла, так что можно формально рассматривать алмаз как трёхмерный полимер, где мономер – атом С (рис. 28).
В кварце нет молекул SiО2 с двойными связями, подобных молекулам СО2, которые должны были бы быть линейными (СЧSi = 2)! Кварц –
|
это трёхмерная полимерная макромолекула (–OSiO–)n, в которой
|
каждый кислород мостиковый, связывает s–связями одновременно два соседних атома Si. Повторяющимся в пространстве фрагментом (структурным мотивом) являются кремнекислородные тетраэдры, о которых уже подробно говорилось в подразд. 3.6, образующие пересекающуюся во всех трёх измерениях структуру. Валентные углы ÐОSiO и ÐSiОSi близки к тетраэдрическим, так как СЧSi = СЧО = 4, КЧSi = 4, КЧО = 2[†].
Природа связи определяет свойства ковалентных кристаллов – физические и химические. Больша́я энергия ковалентной связи обуславливает прочность таких кристаллов в широком смысле – как к термическим, так и к механическим воздействиям. Поэтому они имеют высокие температуры плавления (не менее 1000º С, например для SiО2 1728º С), ещё бо́льшие температуры кипения и большу́ю твердость (10 у алмаза по Моосу). Направленность ковалентной связи затрудняет механическую деформацию, такие кристаллы отличаются низкой пластичностью и высокой хрупкостью. Насыщаемость ковалентной связи приводит к небольшим координационным числам атомов в атомно-ковалентных кристаллах, совпадающих с типичными значениями ковалентности элементов (3, 4, редко 6) и как следствие к невысокой плотности.
Ковалентные кристаллы, как и все молекулярные соединения, – стехиометрические.
Одно и то же соединение может в твёрдом состоянии иметь различные структуры – полиморфные модификации.
Углерод в графите находится в sp2-гибридизации и может образовывать плоскую макромолекулу из шестиугольников (эти плоские слои удерживаются вместе благодаря более слабым, чем ковалентные, межмолекулярным вандерваальсовым взаимодействиям). Это другая полиморфная модификация углерода – графит. Углерод в sp‑гибридизации образует цепочечный карбин, получен икосаэдрический углерод, частицы которого напоминают по форме футбольный мяч (фуллерены – С60 и др.). И хотя всё это разные формы углерода и некоторые химические свойства этих веществ одинаковы (все горят до СО2), в целом их химические свойства различны (в алмазе нет кратных связей и т. п.) и отличаются от свойств свободных, изолированных атомов С. Потому связи, объединяющие атомы в ковалентные кристаллы, химические.
Вопросы для самопроверки
1. Что такое ковалентные кристаллы – полимеры; гигантские молекулы; что-то иное?
2. Почему ковалентные кристаллы имеют высокие температуры плавления и кипения?
3. Почему ковалентные кристаллы имеют высокую твёрдость?
4. Возможно ли в ковалентных кристаллах КЧ = 12?
5. Попробуйте объяснить уменьшение температур плавления и кипения, а также твёрдости в ряду имеющих одинаковые структуры С(алмаз) – Si – Ge.
– Конец работы –
Эта тема принадлежит разделу:
ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ
На сайте allrefs.net читайте: "ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Ковалентные кристаллы
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов