рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Диполь-дипольные взаимодействия
Реферат Курсовая Конспект
Диполь-дипольные взаимодействия
Диполь-дипольные взаимодействия - раздел Химия, ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ Существуют Вещества, Молекулы Которых Сохраняются При Переходе В Конденсирова...
Существуют вещества, молекулы которых сохраняются при переходе в конденсированное состояние. Такие кристаллы называют молекулярными. Какие силы удерживают молекулы в конденсированном состоянии в подобных веществах?
Прежде всего это диполь-дипольное взаимодействие (иначе – вандерваальсовое, в честь впервые рассмотревшего его голландского учёного Ван-дер-Ваальса). Если электрический заряд притягивается (или отталкивается, в зависимости от знака) внешним электрическим полем, то диполь стремится ориентироваться в поле так, чтобы вектор его дипольного момента был направлен по полю. Для зарядов это приводит к их взаимному притяжению-отталкиванию (известный закон Кулона), а для диполей – к взаимной ориентации и взаимному притяжению (иногда это называют ориентационной поляризацией). Напряженность создаваемого вокруг диполя электрического поля падает ~1/R3 (а не ~1/R2, как для точечного заряда), и энергия взаимодействия диполей уменьшается с расстоянием быстрее: Ед-д ~1/R6 (а не ~1/R, как для зарядов). Диполь-дипольное взаимодействие – более короткодействующее, чем кулоновское, и его энергия для полярных молекул не превышает ~ 0,05 эВ (5 кДж/моль), что на порядки меньше энергии ковалентной связи.
И любой заряд, и диполь создают вокруг себя электрическое поле. Поэтому катионы притягивают электроны, а анионы отталкивают, что сопровождается рассмотренной в подразд. 4.2 поляризацией. Диполи также обладают поляризующим действием, хотя и меньшим, чем ионы. Поляризующее действие диполя тем больше, чем больше его дипольный момент и меньше размер.
Именно диполь-дипольное взаимодействие удерживает вместе молекулы углеводородов в жидком бензине или в нефти, или в сжиженном при повышенном давлении природном газе, или в твердых иоде, белом фосфоре, аспирине и т. п. Во всех твердых веществах, относящихся к молекулярным кристаллам, межмолекулярные взаимодействия, удерживающие молекулы в узлах кристаллической решетки, диполь-дипольные.
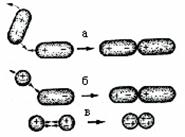
Существует три типа диполь-дипольных взаимодействий, схематично показанных на рис. 30.
1. Ориентационное – взаимодействие между постоянными диполями. Энергия такого взаимодействия прямо пропорциональна дипольному моменту взаимодействующих диполей: Еор. ~р1р2/r6, где р1 и р2 – величины дипольных моментов, r – расстояние между диполями. Так взаимодействуют молекулы, имеющие отличный от 0 дипольный момент НСl, Н2S, SО2, и др.
2. Любой диполь создает вокруг себя электрическое поле. Это поле, в свою очередь, приводит к смещению зарядов в окружающих частицах – положительных – по полю, отрицательных – против поля. Вследствие такого смещения ядра и электронов в молекуле, оказавшейся в поле соседнего диполя (причем эффект будет заметен только при очень малых расстояниях, ~1 Å, когда молекулы практически соприкасаются – не забывайте про 1/R6), происходит пространственное разделение центров положительного и отрицательного зарядов – возникает (наводится) дипольный момент. В свою очередь, наведенный дипольный момент второй частицы взаимодействует с первым – это индукционное(или наведенное)взаимодействие. Говорят еще, что вторая частица поляризуется первой.
При этом способности разных молекул поляризоваться разные. Способность молекулы приобретать наведенный дипольный момент в электрическом поле называют поляризуемостью.В узком смысле поляризуемость a – величина дипольного момента, наведенного электрическим полем единичной напряженности, определяемая из уравнения (ре)нав. = 4pe0aE, где (ре)нав. – величина наведенного дипольного момента, E – напряженность поля. В этом случае энергия взаимодействия зависит еще и от поляризуемости a: Еинд. ~ р1a2р2/r6 (при взаимодействии одинаковых молекул ~ aр2/r6).
 Величина поляризуемости a (размерность м3 в системе СИ) в общем зависит от способности электронов смещаться в электрическом поле. Чем слабее связаны электроны в молекуле, тем легче они смещаются полем. Понятно, что поляризуемость тем больше, чем удаленнее валентные электроны от ядер; поляризуемость p‑связей в общем больше, чем s‑связей, и т. п.
Величина поляризуемости a (размерность м3 в системе СИ) в общем зависит от способности электронов смещаться в электрическом поле. Чем слабее связаны электроны в молекуле, тем легче они смещаются полем. Понятно, что поляризуемость тем больше, чем удаленнее валентные электроны от ядер; поляризуемость p‑связей в общем больше, чем s‑связей, и т. п.
 Таким образом, реальная энергия взаимодействия двух полярных молекул всегда включает оба вклада – ориентационный и индукционный. Например, для обладающей больши́м дипольным моментом, но относительно небольшой по величине и не имеющей p‑связей молекулы НСl преобладает ориентационное взаимодействие, а для большей и имеющей p‑связи (т. е. более поляризуемой) SО2 оба вклада сопоставимы.
Таким образом, реальная энергия взаимодействия двух полярных молекул всегда включает оба вклада – ориентационный и индукционный. Например, для обладающей больши́м дипольным моментом, но относительно небольшой по величине и не имеющей p‑связей молекулы НСl преобладает ориентационное взаимодействие, а для большей и имеющей p‑связи (т. е. более поляризуемой) SО2 оба вклада сопоставимы.
3. Однако, пусть и при достаточно низких температурах, жидкое и твердое состояние существует и для таких веществ, молекулы которых не имеют дипольного момента: О2, Аr и др. Как объяснить несомненное наличие межмолекулярного взаимодействия в этих случаях?
Как изложено в разд. 2, электроны в атомах (и молекулах) находятся в постоянном движении. В произвольно зафиксированный момент времени практически невероятно, чтобы центр расположения всех отрицательных зарядов атома совпал с положением ядра – центры положительных и отрицательных зарядов любой частицы не совпадают и хаотически меняют свои положения со временем (конечно, амплитуда такого несовпадения невелика, ~ 0,1 Å). В каждый момент времени у любой частицы имеется некоторый виртуальный дипольный момент, величина и направление которого все время меняются. Естественно, что в среднем он равен нулю (этот средний дипольный момент называют постоянным). Однако оказавшиеся на достаточно близком расстоянии две неполярные частицы могут иметь некоторые виртуальные диполи (ре)в1 и (ре)в2, ориентация которых обеспечивает их притяжение друг к другу с энергией Едисп. ~a1a2/r6 (для одинаковых частиц ~a2/r6). Это взаимодействие виртуальных диполей называется дисперсионным. Оно не только не уступает по величине ориентационному и индукционному, но и часто (для не слишком малых частиц) превосходит их.
– Конец работы –
Эта тема принадлежит разделу:
ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ
На сайте allrefs.net читайте: "ХИМИЧЕСКАЯ СВЯЗЬ В КОНДЕНСИРОВАННОМ СОСТОЯНИИ"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Диполь-дипольные взаимодействия
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов