Лекция № 4. Кинетика химических реакций
Лекция № 4. Кинетика химических реакций.
Между значением DG и скоростью нет зависимости (нельзя сказать, что чем больше по абсолютному значению DG, тем быстрее достигается равновесие), так… 2NO (г) + O2(г) = 2NO2 (г); DG0298= -70 кДж 2H2 (г) +O2(г)=2H2O(г); DG0298 = -447 кДжОт Т
От катализатора
5) от р (газы) 6) от площади соприкосновения 7) от среды (для реакций в растворах)Необратимые реакции
0-порядок по веществу встречается в гетерогенных реакциях. Для реакций нулевого порядка кинетическое уравнение имеет следующий вид: (II.5) Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это…Реакции третьего порядка
А + В + С→ Е + F

[k]=л2/моль2 с
Примеры: 2NO (г) + O2(г) = 2NO2 (г)
Дать графики со стр. 23 Семиохин.
Методы определения порядка реакции и констант скорости из экспериментальных данных.
Графический метод (линеаризация) (lnc–t; 1/c –t; 1/c2–t)заключается в построении графика зависимости концентрации реагента от времени в различных… Надо найти, в каких координатах график зависимости с=f(t) спрямляется. Если построить графики этих зависимостей на…Влияние температуры на константу скорости реакции
При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза. Величина, показывающая, во сколько раз увеличивается константа скорости при… (II.29)Уравнение Аррениуса
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию. Уравнение Аррениуса описывает зависимость константы скорости реакции от… (II.36)Существует 2 подхода к рассмотрению элементарного акта.
1) Теория активных соударений
2) Теория активированного комплекса.
Теория активных соударений
· протекание реакции обусловлено столкновениями между реагирующими частицами · не каждое столкновение приводит к реакции, а только эффективное,… · столкновение приводит к реакции только, если частицы определенным образом ориентированы в пространстве.Теория активированного комплекса.
Рассмотрим путь некоторой элементарной реакции А B + C ––> A…B…С→ А + ВС Перераспределении связей происходит через образование активированного комплекса. Этот комплекс имеет избыток…Дать энтальпийные диаграммы – энергетические диаграммы реакции – с.237, Карапетьянц).
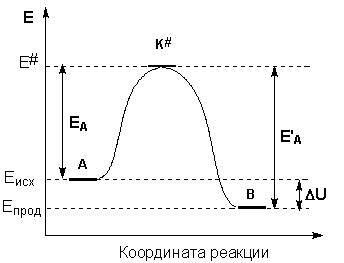
Рис. 2.5 Энергетическая диаграмма химической реакции.
Eисх – средняя энергия частиц исходных веществ, Eпрод – средняя энергия частиц продуктов реакции