рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- За натрій оксалатом методом піпетування
Реферат Курсовая Конспект
За натрій оксалатом методом піпетування
За натрій оксалатом методом піпетування - раздел Образование, Титриметричний аналіз Стандартизація Розчину Калій Перманганату За Натрій Оксалатомописується Рівня...
Стандартизація розчину калій перманганату за натрій оксалатомописується рівнянням реакції:

|  В; В;
| |
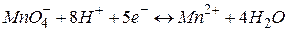
|  В. В.
|
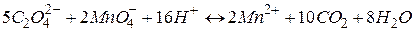
Стандартизацію розчину калій перманганату зручніше проводити методом піпетування. Суть його полягає в тому, що готують у мірній колбі розчин первинного стандарту (натрій оксалату Na2C2O4), відбирають піпеткою його аліквоту, яку титрують розчином KMnO4.
Приготування стандартного розчину натрій оксалату.Розраховують масу Na2C2O4, необхідну для приготування 200 або 250 cм3 розчину з концентрацією  (об'єм розчину визначається об’ємом мірної колби):
(об'єм розчину визначається об’ємом мірної колби):
 .
.
 ;
;  г/моль.
г/моль.
Беруть близьку до розрахованої наважку натрій оксалату, переносять її у мірну колбу, розчиняють у невеликій кількості дистильованої води, доводять об’єм водою до риски, закривають колбу корком і старанно перемішують. Обчислюють концентрацію отриманого стандартного розчину натрій оксалату:
 .
.
Методика визначення.Заповнюють бюретку одержаним розчином калій перманганату. У конічну колбу наливають ~ 100 см3 дистильованої води, 20 см3 H2SO4 (1:4) та добавляють декілька кристаликів MnSO4 (реакція є автокаталітичною, тому додавання Mn2+ пришвидшує її). Розчин нагрівають до 80-90 0С, але не кип’ятять.
Піпеткою відбирають аліквотну частину (20 або 25 см3) стандартного розчину Na2C2O4 і добавляють у колбу з гарячим розчином кислоти.
Одержану суміш повільно титрують калій перманганатом при безперервному перемішуванні розчину. Кожну нову порцію титранту добавляють тільки після зникнення забарвлення від попередньої порції.
Титрування закінчують при появі блідо-рожевого забарвлення розчину, яке не зникає протягом 30 с.
Титрування проводять не менше 3-х разів, кожен раз записуючи об’єм розчину KMnO4, витрачений на титрування. Обчислюють середнє значення Vcep(KMnO4) для результатів, різниця між якими є не більшою, ніж 0,1 см3.
Розраховують концентрацію стандартного розчину калій перманганату:
 .
.
Лабораторна робота № 6
– Конец работы –
Эта тема принадлежит разделу:
Титриметричний аналіз
національний університет Львівська політехніка... Титриметричний аналіз Методичні вказівки для студентів хімічних...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: За натрій оксалатом методом піпетування
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов