рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Дихроматометричне титрування
Реферат Курсовая Конспект
Дихроматометричне титрування
Дихроматометричне титрування - раздел Образование, Титриметричний аналіз Стандартний Розчин K2Cr2O7...
Стандартний розчин K2Cr2O7 готують за точною наважкою хімічно чистої сухої солі або з фіксаналу. При титруванні калій дихроматом різних відновників відбувається відновлення хрому (VI) до хрому (III):
 ;
;
 .
.
Титрування калій дихроматом ведуть у сильно кислому середовищі. Солі хрому (III), які утворюються в результаті реакції, забарвлюють розчин у зелений колір, тому розчин перед титруванням необхідно розбавити. Для фіксування точки еквівалентності використовують окисно-відновний індикатор, переважно дифеніламін або фенілантранілову кислоту [1, с. 80].
Лабораторна робота № 7
дихроматометричне Визначення ФЕРУМУ (ІІ)
Визначення феруму (ІІ) описується рівнянням реакції:
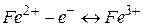
| 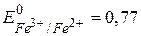 В; В;
| |

|  В. В.
|

При використанні дифеніламіну як індикатора, титрування проводять у присутності фосфатної кислоти, яка утворює з йонами Fe3+ безбарвну комплексну сполуку:
 .
.
Утворення такого комплексу зменшує концентрацію іонів Fe3+ і, відповідно, знижується значення окисно-відновного потенціалу пари Fe3+/Fe2+. Межі стрибка титрування розширюються вiд 0,76 В до 1,30 В і показник титрування дифеніламіну (рТ = 0,76 В) потрапляє у межі стрибка [1]. Це забезпечує необхідну точність фіксування точки еквівалентності, бо дифеніламін змінює своє забарвлення в межах стрибка титрування.
Методика визначення.Масу наважки проби, яку необхідно взяти для аналізу, розраховують за формулою:
 [г].
[г].
Для розрахунку використовують такі значення: ω(Fe) ~ 10 %;  M;
M;  см3;
см3;  ;
;  г/моль.
г/моль.
Беруть наважку аналізованої проби, близьку до розрахованої, висипають у колбу для титрування місткістю 500-700 см3 і розчиняють у 20 см3 H2SO4 (1:4).
Після повного розчинення приливають 10 см3 Н3РО4 (ω(Н3РО4) = 30 %), 200-250 см3 дистильованої води і 1-2 краплі розчину дифеніламіну.
Титрують розчином калій дихромату до появи переходу світло-зеленого забарвлення у стійке синьо-фіолетове (при наближенні до точки еквівалентності титрують повільніше, старанно перемішуючи розчин).
Розраховують масову частку феруму в пробі за формулою:
 [%].
[%].
– Конец работы –
Эта тема принадлежит разделу:
Титриметричний аналіз
національний університет Львівська політехніка... Титриметричний аналіз Методичні вказівки для студентів хімічних...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Дихроматометричне титрування
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов