рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Приготування розчину кислоти заданої концентрації
Реферат Курсовая Конспект
Приготування розчину кислоти заданої концентрації
Приготування розчину кислоти заданої концентрації - раздел Образование, Титриметричний аналіз Студент Одержує У Викладача Індивідуальне Завдання Для Пригот...
Студент одержує у викладача індивідуальне завдання для приготування певного об'єму (V, см3) кислоти (HCl чи H2SO4) заданої концентрації (С, M) з більш концентрованого розчину кислоти густиною ρ (г/ см3).
Щоб приготувати заданий об'єм розчину кислоти (V), необхідно розрахувати об’єми кислоти V1(кислоти) з густиною ρ і води V2(Н2О), які необхідно змішати (див. приклад розрахунку, с. 7).
Одержані результати записують у таблицю.
| Індивідуальне завдання | Результат | ||||
| Кислота | С, М | V, см3 | ρ, г/ см3 | V1 (кислоти) , см3 | V2 (H2O) , см3 |
Розчин кислоти готують у пронумерованих склянках місткістю 1 дм3. Розраховані об'єми кислоти V1(кислоти) і води V2(H2O) відмірюють мірними циліндрами і переносять у склянку, причому спочатку наливають воду, а потім доливають кислоту.
Приклад розрахунку. Обчислити, який об’єм (см3) сульфатної кислоти з густиною ρ(H2SO4) = 1,14 г/см3 необхідно взяти, щоб приготувати 700 см3 розчину H2SO4 з концентрацією  .
.
Об’єм H2SO4 з густиною 1,14 г/см3, необхідний для приготування заданого об’єму розчину, можна розрахувати двома способами.
І спосіб.
Розраховуємо масу чистої кислоти, потрібну для приготування 700 см3 розчину H2SO4 з концентрацією  за формулою:
за формулою:
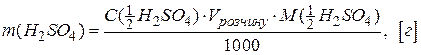 .
.
Оскільки сульфатна кислота є сильним двохосновним електролітом, то обидва йони гідрогену беруть участь в реакціях нейтралізації. Тому фактор еквівалентності сульфатної кислоти 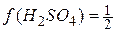 , а молярна маса еквівалента
, а молярна маса еквівалента 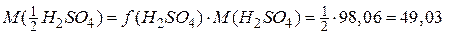 г/моль.
г/моль.
Використавши дані задачі отримаємо:
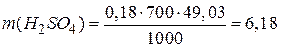 г.
г.
Користуючись довідником [4] знаходимо, що у розчині сульфатної кислоти з густиною 1,14 г/см3 міститься 20,08 % H2SO4. Враховуючи масову частку, розраховуємо масу розчину за формулою:
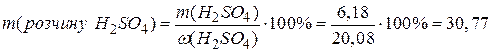 г.
г.
Знаючи густину розчину, знаходимо його об’єм:
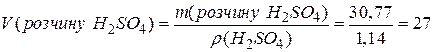 см3.
см3.
ІІ спосіб.
У довіднику [4] також вказано, що молярна концентрація розчину сульфатної кислоти з густиною 1,14 г/см3 дорівнює 2,334 моль/дм3. Оскільки 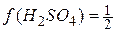 , то молярна концентрація еквівалента
, то молярна концентрація еквівалента 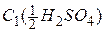 дорівнює:
дорівнює:
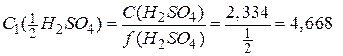 моль/дм3.
моль/дм3.
Використаємо закон еквівалентів:
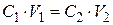 ,
,
звідки знайдемо об’єм V1 розчину кислоти, потрібний для приготування 700 см3 (V2) розчину H2SO4 заданої концентрації (С2).
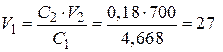 см3.
см3.
В обох випадках об’єм води V(H2O), до якого треба долити 27 см3 сульфатної кислоти з густиною 1,14 г/см3, дорівнює:
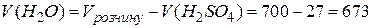 см3.
см3.
Відповідь: щоб приготувати 700 см3 розчину H2SO4 з концентрацією  необхідно змішати 673 см3 води і 27 см3 H2SO4 з густиною ρ(H2SO4) = 1,14 г/см3.
необхідно змішати 673 см3 води і 27 см3 H2SO4 з густиною ρ(H2SO4) = 1,14 г/см3.
Лабораторна робота № 2
Стандартизація розчину кислоти (HCl або H2SO4)
– Конец работы –
Эта тема принадлежит разделу:
Титриметричний аналіз
національний університет Львівська політехніка... Титриметричний аналіз Методичні вказівки для студентів хімічних...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Приготування розчину кислоти заданої концентрації
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов