рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Титриметричного аналізу
Реферат Курсовая Конспект
Титриметричного аналізу
Титриметричного аналізу - раздел Образование, Титриметричний аналіз Проведення Кількісного Хімічного Аналізу Є Неможливим Без Зас...
Проведення кількісного хімічного аналізу є неможливим без застосування спеціальних пристроїв і хімічного посуду [3].
Для вимірювання маси речовини використовують лабораторні ваги, які бувають технічні і аналітичні.
Технічні ваги призначені для зважування речовин масою від 100 до 1000 г з точністю до ±0,01 г.
За допомогою аналітичних ваг можна зважувати не більше 200 г речовини з точністю до ±0,0001 г.
Хімічний посуд за призначенням поділяють на:
- посуд загального призначення (хімічні стакани, колби, лійки, бюкси);
- посуд спеціального призначення (холодильники, круглодонні колби);
- мірний посуд (мірні циліндри, піпетки, бюретки, мірні колби).

| Хімічні стакани (1) – це циліндри з носиком чи без, які виготовляють зі скла, полімерних матеріалів чи кераміки. Якщо на стінках нанесено мірні риски, то його називають мірним стаканом. Для титрування використовують конічні колби (2) Ерленмейєра об’ємом від 50 до 1000 см3, які виготовляють зі звичайного чи термостійкого скла. |
Мірний посуд буває точний і неточний. Наприклад, мірні циліндри (3) використовують для приблизного вимірювання об’ємів.
Для точного вимірювання об’ємів, титрування і приготування стандартних розчинів у кількісному хімічному аналізі використовують точний мірний посуд - піпетки, бюретки, мірні колби.
Бюретка (4) призначена для проведення титрування – це вузька скляна трубка з поділками, які показують об’єм вилитої з неї рідини.
Поділки нанесено за довжиною бюретки зверху вниз. Об’єм розчину між двома сусідніми великими поділками становить 1 см3. Ця відстань розділена ще на 10 частин. Тому ціна кожної поділки дорівнює 0,1 см3.
| Нижня частина бюретки має звуження, до якого за допомогою еластичної трубки зі скляною кулькою всередині під’єднана скляна трубка з витягнутим кінцем, яку називають “носиком”. Скляна кулька виконує роль крана. Її діаметр є трохи більшим від внутрішнього діаметра гумової трубки, тому вона перешкоджає самочинному виливанню рідини. При першому заповненні бюретки слід звернути увагу, щоб у нижній частині не було бульбашок повітря. Для цього достатньо загнути “носик” бюретки вгору і, натиснувши на кульку, витіснити повітря титрантом. | ||
| Для точного вимірювання об’єму розчину використовують піпетки. Точний кратний об’єм розчину, відміряний піпеткою, називають аліквотою. Піпетки (5) фіксованого об’єму (100, 50, 25, 10, 5, 2, 1 см3) – це довгі вузькі скляні трубки, які бувають з розширенням посередині або без нього і однією міткою (рискою) у верхній частині. Іноді їх називають піпетками Мора. Градуйовані піпетки (6) схожі на бюретки, бо мають поділки для вимірювання вилитого об’єму розчину. Перед роботою піпетку ополіскують розчином реактиву, об’єм якого необхідно відміряти. При наповненні піпетки її кінчик весь час має бути зануреним у розчин, а при виливанні – торкатися поверхні розчину, щоб запобігти розбризкуванню. Мірні колби (7) - це плоскодонні колби з подовженими шийками малого діаметру та нанесеними мірними рисками. Мірні колби використовуються для приготування розчинів точної концентрації за масою та об’ємом і для розбавлення досліджуваного розчину до певного об’єму. Розчини вносять у мірні колби піпетками, а наважки речовин переносять через лійку, яку після цього обов’язково ополіскують розчинником. Останні порції розчинника додають краплинами, поки |  5 6
5 6

| ||
нижній меніск рідини в колбі співпаде з рискою.
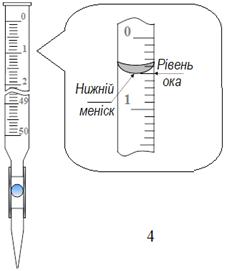
При вимірюванні об’єму розчину у бюретці, піпетці чи мірній колбі мірний посуд розташовують вертикально.
Око спостерігача має перебувати на одній горизонтальній лінії з нижнім краєм меніска, якщо рідина прозора, і верхнім - якщо рідина забарвлена.
– Конец работы –
Эта тема принадлежит разделу:
Титриметричний аналіз
національний університет Львівська політехніка... Титриметричний аналіз Методичні вказівки для студентів хімічних...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Титриметричного аналізу
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов