рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Стандартизація за розчином калій дихромату
Реферат Курсовая Конспект
Стандартизація за розчином калій дихромату
Стандартизація за розчином калій дихромату - раздел Образование, Титриметричний аналіз Стандартний Розчин Натрій Тіосульфату Na2...
Стандартний розчин натрій тіосульфату Na2S2O3·5H2O не можна приготувати за точною наважкою [1, с. 74], тому готують розчин приблизної концентрації.
Розраховують величину наважки Na2S2O3·5H2O, необхідну для приготування 200 чи 250 см3 ~0,1 М розчину за формулою:
 .
.
 ;
;  г/моль.
г/моль.
Зважують на технічних вагах близьку до розрахованої масу натрій тіосульфату і переносять у склянку з темного скла місткістю 250 см3, приливають відповідний об'єм дистильованої води і перемішують.
Для збільшення стійкості розчину натрій тіосульфату до нього додають ~0,05 г Na2CO3.
Оскільки реакція між калій дихроматом і натрій тіосульфатом відбувається нестехіометрично (не може бути записана одним рівнянням), то концентрацію розчину Na2S2O3 встановлюють методом заміщення. Цей спосіб ґрунтується на реакціях:
 ;
;
 .
.
 ;
;
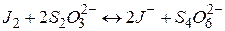 .
.
Як індикатор використовують свіжо-приготований розчин крохмалю.
Методика визначення.У конічну колбу місткістю 500-700 см3 переносять зважені на технічних вагах ~ 2 г KJ і доливають 10-15 см3 2 М розчину Н2SO4. До одержаної суміші добавляють піпеткою 20 або 25 см3 розчину K2Cr2O7 з концентрацією  , добре перемішують, накривають колбу годинниковим склом і ставлять в темне місце для завершення реакції. Через 2-3 хвилини розчин розбавляють водою до об’єму 200-250 см3 і титрують розчином натрій тіосульфату, безперервно перемішуючи вміст колби.
, добре перемішують, накривають колбу годинниковим склом і ставлять в темне місце для завершення реакції. Через 2-3 хвилини розчин розбавляють водою до об’єму 200-250 см3 і титрують розчином натрій тіосульфату, безперервно перемішуючи вміст колби.
При титруванні темно-бурий розчин поступово світлішає і стає жовто-зеленим. Тоді приливають 2-3 см3 розчину крохмалю, після чого розчин повинен стати темно-синім або майже чорним. Титрування продовжують, при цьому інтенсивність синього забарвлення поступово слабшатиме і у точці еквівалентності забарвлення розчину зміниться із синього на світло-зелене. Останні краплі розчину натрій тіосульфату додають повільно, добре перемішуючи розчин. Записують об'єм розчину Na2S2O3, витрачений на титрування виділеного йоду, і розраховують концентрацію стандартного розчину натрій тіосульфату:

Титрування повторюють не менше, ніж 2-3 рази і розраховують середнє значення концентрації розчину натрій тіосульфату.
Лабораторна робота № 9
– Конец работы –
Эта тема принадлежит разделу:
Титриметричний аналіз
національний університет Львівська політехніка... Титриметричний аналіз Методичні вказівки для студентів хімічних...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Стандартизація за розчином калій дихромату
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов