рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- За натрій тетраборатом методом окремих наважок
Реферат Курсовая Конспект
За натрій тетраборатом методом окремих наважок
За натрій тетраборатом методом окремих наважок - раздел Образование, Титриметричний аналіз Стандартизація Описується Рівнянням Реакції: ...
Стандартизація описується рівнянням реакції:
 ;
;
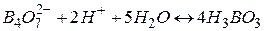 .
.
З рівняння реакції видно, що молекула натрій тетраборату взаємодіє з двома йонами водню. Тому фактор еквівалентності солі 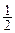 , а молярна маса еквівалента:
, а молярна маса еквівалента:
 г/моль.
г/моль.
Розрахунок величини наважки.Для встановлення точної концентрації (стандартизації) розчину кислоти методом окремих наважок беруть декілька (не менше трьох) близьких за величиною наважок речовини-стандарту, розчиняють їх у невеликому об’ємі води (приблизно 50 – 100 см3) і титрують у присутності відповідного індикатора.
Величина наважки повинна бути такою, щоб на її титрування витрачалося 30-40 см3 кислоти (якщо використовують бюретку місткістю 50 см3).
Величину наважки  розраховують за кількістю моль-еквівалентів реагуючих речовин у точці еквівалентності:
розраховують за кількістю моль-еквівалентів реагуючих речовин у точці еквівалентності:
 .
.
Вибір індикатора. З рівняння реакції видно, що у точці еквівалентності в реакційній суміші знаходиться натрій хлорид і слабка ортоборатна кислота, яка зумовлює слабо кислу реакцію розчину. Значення рН розчину розраховують за формулою для слабких кислот:
 .
.
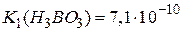 ;
; 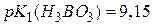 ;
;  М.
М.
 .
.
Кінцеву точку тирування встановлюють за зміною забарвлення індикатора, показник титрування якого рТ = РНт.е. ± 0,5 [1]. Для даного випадку найпридатнішим є індикатор метиловий червоний (рТ = 5,2).
Методика визначення. Беруть близьку до розрахованої наважку натрій тетраборату (для зважування використовують скляний бюкс). Переносять її у конічну колбу об’ємом 250 см3 і розчиняють у 80-100 cм3 дистильованої води. Додають 1-2 краплі індикатора метилового червоного, який забарвлює розчин у жовтий колір. Заповнюють бюретку розчином кислоти і титрують, безперервно перемішуючи вміст колби плавними круговими рухами, до появи блідо-рожевого забарвлення, яке не зникає протягом 30 с.
Результат зважувань і об'єм кислоти, витрачений на титрування взятої наважки з точністю до 0,05 см3, записують у таблицю.
| № | Маса солі у бюксі m1, г | Маса залишку солі m2, г | Маса солі m3, г | Об’єм кислоти V, см3 | Концентрація кислоти С, М | Титр кислоти Т, г/см3 |
| 1. | ||||||
| 2. | ||||||
| … | ||||||
| Ссер = | Тсер = |
Молярну концентрацію еквівалента і титр стандартного розчину кислоти розраховують за формулами:
 ;
;
 .
.
Стандартизацію розчину кислоти повторюють не менше 3-х разів (різниця трьох значень концентрації кислоти має бути не більшою, ніж 0,0009 М) та проводять статистичну обробку результатів аналізу (див. стор. 11).
Лабораторна робота № 3
– Конец работы –
Эта тема принадлежит разделу:
Титриметричний аналіз
національний університет Львівська політехніка... Титриметричний аналіз Методичні вказівки для студентів хімічних...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: За натрій тетраборатом методом окремих наважок
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов